
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химиялық кинетиканың негізгі ережелеріне сүйене отырып химиялық реакцияның температураға тәуелділігін талдаңыз
.Заттар әрекеттесу үшін олардың бөлшектерінің өзара кездесіп соқтығысуы қажет дедік. Соқтығысу нәтижесінде бөлшектердің электрон бүлттарының тығыздықтары өзгеріп, жаңа химиялық байланыстар түзіледі. Тәжірибе жүзінде температура әрбір 10°С-қа артқанда реакция жылдамдығы 2—4 есе өсетіндігі анықталған. Бұл ереже оны ашқан автордың есімімен Вант-Гофф ережесі деп аталады.
Вант-Гофф ережесінің математикалық теңдеуін жылдамдық константаларының не жылдамдықтардың арақатынасы арқылы өрнектесек:
 =γ=2-4
=γ=2-4  =γ
=γ  5. 9
5. 9
γ-жылдамдықтың температуралық коэффициенті, жоғарыда айтқандай оның мәні 2-4 аралығында жатады. Бұл қатынастардың жуықтай орындалатынына қарамастан көптеген үдерістердің температураға тәуелділігін білуде маңызды роль атқарады. Айталық, t градус температурада 1 сағатта аяқталатын реакция t-100 градуста 1·210, яғни 1000 сағатқа немесе 40 күнге созылады, ал t + 100 градуста не бары 1·2-10=3,6 секундта өтеді.
Қызудың аз ғана жоғарылауы химиялық үдерістің жүру жылдамдығын неге соншама арттырады? Температура артқанда бөлшектердің қозғалысы шапшаңдап, соқтығысу саны көбейеді. Алайда температура 10 градусқа, жоғарылағанда бөлшектердің жылдамдығы бар болғаны 1-2% қана артады. Соған қарамастан жылдамдықтың күрт өзгеруінің сырын түсіну үшін әрекеттесетін ортада болатын белсенді бөлшектермен, олардың ерекшеліктерімен танысқан жөн.
Кез келген химиялық реакция жүру үшін қажетті әрі жеткілікті шарт - тек бөлшектердің өзара соқтығысуы ғана болса, онда бірдей концентрациялы реагенттердің әрекеттесу жылдамдығының әр түрлі болуын түсіндіре алмас едік. Әр соқтығысудың нәтижесінде әрекеттесу акты туа берсе, реакция атаулының бәрі қопарылыстың жылдамдығындай шапшаңдықпен жүрер еді. Шынында 1 см3 көлемдегі газдың молекулаларының соқтығысу саны бойынша жылдамдығын есептеп тапса, ол іс жүзіндегі жылдамдықтан миллиардтаған есе асып түседі.
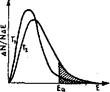
Қозғалыстағы белшектердің бәрінің жылдамдығы бірдей болуы мүмкін емес. Егер Максвелл заңына орай молекулалардың кинетикалық энергиясы бойынша таралу қисығын салса (85-сурет) олардың негізгі дені орташа бір жылдамдықпен қозғалып, соған сай орташа кинетикалық энергияға ие болатыны көрінеді. Ал біразының энергиясы одан көп не азырақ болады.
Әрекеттесетін бөлшектердің соқтығысқан кездегі энергиясы олардың электрон қауыздарының бірін-бірі тебу күшінен басым болуы қажет, яғни барлық соқтығысулардың бәрі емес, тек белсенді соқтығысулар ғана реакция жүруіне әкеп соғады. Міне осындай «белсенді» деп аталған молекулалардың жылдамдығы орташа жылдамдықтан жоғары, соған сай энергиясы да мол болып келуі тиіс. Белсенді молекулалардың энергия қоры олар түйіскен кезде әрекеттесе алатындай дәрежеде болады. Кез келген белсенді емес молекуланы белсенді ету үшін оның кинетикалық энергиясын белсенді энергия шамасына жеткізу қажет. Сол үшін реакция жүріп жатқан ортаның температурасын Т1 ден Т2 дейін жоғарылатып қыздырса, барлық бөлшектердің жалпы кинетикалық энергиясы артып, таралу қисығы оңға қарай ығысады, белсенді бөлшектердің үлесі де молаяды (85-сурет).
Дата добавления: 2015-01-01; просмотров: 405; Мы поможем в написании вашей работы!; Нарушение авторских прав |