
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Жұмсақ және қатты қышқылдар мен негіздердің теориясы. Автопротолизді негіздеңіз
Элементтердің тотығу дәрежесі өзгермейтін реакциялардың көпшілігі қышқыл-негіздік тепе-теңдікпен жүреді. Оларды "қышқыл" және "негіз" деп жіктеуге болады.
Химиялық реакцияларда ең жиі қолданылатын еріткіш-су, сондықтан Аррениус теориясында да су қолданылған.
| Теория | Қышқыл | Негіз |
| Аррениус | Иондар түзіле диссоциацияланады H+ (HNO3 және т.б.) | Иондар түзіле диссоциацияланады OH- (NaOH және т.б.) |
| Бренстед-Лоури | Протондар доноры (HN4+, HCl, [Cu(H2O)6]2+) | Протондар акцепторы (NH3, OH-, PO43- және т.б.) |
| Кукса-Флуда (балқытпадағы реакция) | Оксид-иондар акцепторы (SiO2) | Оксид-иондар доноры (CaO) |
| Сольво жүйе | Еріткіш катиондарының концентрациясы артады (BrF3-те SbF5) | Еріткіш аниондарының концентрациясы артады (BrF3-те КF) |
| Льюис | Электрон жүптары акцептор (BF3, Ag+және т.б.) | Электрон жүптары донор (NH3, F- және т.б.) |
| Усанович | Катион донор (соның ішінде H+) немесе анион акцептор (соның ішінде электрон жұптары) | Анион донор (соның ішінде электрон жұптары) немесе каиион акцептор (соның ішінде H+) |
Бренстед-Лоури теориясы бұл түсініктерді кеңейтуге мүмкіндік береді және қышқыл-негіздік тепе-теңдікті санмен сипаттауда да өте маңызды, сонымен қатар суды еріткіш ретінеде қолданғанда бұл есептеулер Аррениус теориясымен сәйкес келеді. Сондықтан, Бренстед-Лоури теориясына кеңінен тоқталамыз.
Ерітіндіде Н+ протондары жүруі мүмкін еместігін атап өту керек. Протондардың қаншалық кішкентай болса (10-15м), оларға жақын электрлік өріс соншалықты үлкен болады, сонықтан олар бөлінбеген электрон жұптарын құраушы кез келген молекуланы тартады. Мысалы, сулы ерітінддіе гидроксони ионы (Н3О+) болады, ол мынадай реакциямен түзіледі:
Н+ + Н2О = Н3О+
Бұл реакция жылу бөліну арқылы жүреді, демек гидратталмаған протонның болуы мүмкін еместігін дәлелдейді. Гидроксони ионы кейбір қышқылдардың кристалдық торларына катион ретінде қатысады. Гидроксони ионына барлық үш протонда эквивалентті. Сулы ерітіндіде Н3О+ бөлшегі әрі қарай күрделірек иондар түзіп гидратталуға қабілетті, мысалы Н9О4+. Сулы емес ерітінділерде протон ассоциаттар түрінде болады, аммиакта - NH4+, этанолда - C2H5OH2+.
Бренстед-Лоури теориясы.Бренстед-Лоуридің протолиттік теориясы протонды жеке түрде болуы мүмкін еместігін негіздейді. Бұл теорияның негізгі жағдайы мынадай болады:
1. Қышқыл - бұл протонды беретін зат, яғни донор қызметін атқарады, ал негіз - протондар акцепторы қызметін атқарады.
2. Қышқылдар мен негіздер иондар да, бейтарап бөлшектерде болуы мүмкін.
3. Әрбір қышқылға сәйкес негіз болады. Бұл жұпты қышқыл мен негіздің түйіскен жұбы деп атайды:

қышқыл негіз
Бұл тепе-теңдік Н+ - тің тәуелсіз бола алмайтындығын, яғни реакция шындығын түсіндіре алмайды. Міндетті түрде қышқыл мен негіздің түйіскен екінші жұбы болуы керек.

Түйіскен жұптар
Қышқылдар мен негізддердің түйіскен жұптарына мысалдар төмендегідей:
| түйіскен қышқыл | HCl | NH4+ | H2O | H3O+ | H2SO4 | HSO4- | All(H2O)63+ |
| түйіскен негіз | Cl- | NH3 | OH- | H2O | HSO4- | SO42- | [Al(H2O)5(OH)2+ |
Бренстед-Лоури теориясында гидратталған метал иондары қышқыл рөлін атқарады, сондай-ақ, осын иондардың ішкі сферасында орналасқан су протондар доноры қызметін атқаруы мүмкін.
Протолиттіқ теория әртүрлі ерітінділердегі диссоциация, өздігінен иондану және гидролиз сияқты процесстерді оңай түсіндіреді. Тепе-теңдік мысалдары кестеде келтірілген, мұндағы қосылыстардың қышқыл-негіздік қасиеттері әрекеттесетін түйіскен жұптардың қасиетіне байланысты екендігі көрсетілген. Сулы ортада сірке қышқылы қышқыл болса, ал күкірт қышқылы – негіз болады.
Қышқыл-негіздік теңдеулерге мысалдар
| А1 + В2 ↔ А2 + В1 | Ескертпе |
| HCl+NH3↔NH4++Cl- | Бейтараптану |
| H2O+H2O↔H3O++OH- NH3+ NH3↔ NH4++ NH2- | Өздігінен иондану (автопротолиз) |
| CH3COOH+H2O↔H3O++CH3COO- H2SO4+CH3COOH↔CH3COOH2++ HSO4- | Әртүрлі ерітінділердегі диссоциация |
| H2O+ S2-↔HS-+OH- Al(H2O)63+ + H2O ↔ H3O+ + [Al(H2O)5(OH)]2+ | Гидролиз |
Қышқылдар күшінің сандық сипатын қышқылдық константасы (Ka), яғни реакцияның тепе-теңдік константасы анықтайды:
А↔В+H+
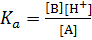
Мұндай тепе-теңдік тек басқа түйіскен жұптар болған жағдайда ғана болады, ал  - ның абсолютті мәнін өзгертуге болмайды. Тек басқа кез келген стандартқа сәйкес қышқылдық константасының мәнін ғана анықтауға болады. Стандартты деп мынадай тепе-теңдік саналады:
- ның абсолютті мәнін өзгертуге болмайды. Тек басқа кез келген стандартқа сәйкес қышқылдық константасының мәнін ғана анықтауға болады. Стандартты деп мынадай тепе-теңдік саналады:
H3O+↔ H2O +H+ 
Одан басқа кез келген қышқыл-негіздік тепе-теңдік үшін:
А1 + В2 ↔ А2 + В1

Сумен әрекеттескен кез келген А қышқылы үшін қышқылдық константасы Аррениус теориясындағыдай және анықтамалық әдебиеттерде келтірілгендей:
A+H2O↔H3O++B-

Бірнеше протонын беруге қабілетті көп негізді қышқыл үшін бірінші қышқылдық константасы кейінгілерінен көбірек болады. Бұл теріс зариядталған ионнан протонның бөлініп шығуының электорстатикалық қиындығына байланысты. ОН тобы бір атомға байланысқан оксоқышқылдар үшін рКа2 мәні рКа1 мәнінен 5-ке үлкен болады. Мысалы, ортофосфорлы қышқылдар үшін рКа1 мәні 2,12; 7,21; 12,67-ге i=1.2.3-ке тең. Демек сулы ортада рН-қа тәуелді болғанда әртүрлі қышқыл-егіздік тепе-теңдіктер басым болады. Суретте ортафосфор қышқылының әртүрлі иондарының мәні келтірілген. Мысалы:

Графиктен көрініп турғандай РН томен болғада  ионының үлесі аз болады, бірақ ион
ионының үлесі аз болады, бірақ ион  басым болуға әрекет жасайды.
басым болуға әрекет жасайды.
Суретте кейбір қышқылдардың рКа шкаласы бойынша қатынасы көрсетілген. Негіздік константасы (Kb) қышқылдық константасы арқылы есептелінеді:
В + H2O ↔ A + OH-

Судың автопротолизі. Ең алдымен судың автопротолизі тепе-теңдігіне тоқталған дұрыс:
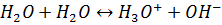
A1 В2 А2 В1
Тепе-теңдіктің термодинамикалық константасы бұл реакция үшін эксперимент арқылы келтірілген. 298 К ол төмендегідей:
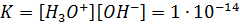
Мұны судың иондық түзілуі деп атайды және Kw таңбасымен белгілейді. Негізінен протолиттік теорияда автопротолиз реакциясының тепе-теңдік константасы судың қышқылдық константасымен бірдей Ка(Н2О).
Kw биіктігі негізінде рН шкаласы анықталады:
Бейтарап ерітінді 
Қышқыл ерітінді 
Сілті ерітінді 
pH өзеруі.Көбінесе ерітінділердің рН өзгеруін қышқыл-негіздік индекаторлар арқылы немесе потегциометриямен анықтайды. Потенциометрия ЭДС өзгерісіне негізделген, ол қандай да бір электродтардың арасындағы Н3О+-тың концентрациясына сезімталдық және электродтарды салыстырғанда пайда болады. Электрқозғаушы күшті рН өзгеруімен байланыстыруға болады және бұл мән рН-метр деп аталатын прибор шкаласымен тікелей есептеледі.
Қышқыл-негіздік индекаторлар негізінде әдетте молекулалық және иондық формасының түстері әртүрлі әлсіз органикалық қышқылдар алынады. Мысалы, лакмус – әлсіз қышқыл, оның HL формуласын келтіру оңай, ерітіндіде диссоциация жүреді:
HL + H2O ↔ H3O+ + L-
қызыл көк
Қышқыл ортада тепе-теңдік диссоциацияланбаған бағытқа қарай ауысады және ерітіндінің түсі қызыл болады. Негіздік ортада H3O+ ионы су молекуласы түзілуіне қатысады. Тепе-теңдік оң жаққа аниондар түзілу бағытына қарай ығысады және ерітінді көк түске енеді. Түстің өзгеруі рН 6-дан 8-ге дейінгі аралықта пайда болады. Әртүрлі индекаторлар әртүрлі рН мәндерінде түсін өзгертеді. Универсалды индекатор – индекаторлар қоспасы, ол ақырындап рН-тың кең аралығында түсін өзгереді.
Дата добавления: 2015-01-01; просмотров: 673; Мы поможем в написании вашей работы!; Нарушение авторских прав |