
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Методические указания по выполнению контрольной работы. В соответствии с учебным планом изучения данной дисциплины студенты выполняют контрольную работу, которая является обязательной частью учебного процесса и без
В соответствии с учебным планом изучения данной дисциплины студенты выполняют контрольную работу, которая является обязательной частью учебного процесса и без успешного написания которой они не допускаются к экзамену.
Рекомендации по оформлению контрольной работы:
- четко оформите титульный лист
- каждое задание выполните с новой страницы
- задания оформите в следующем порядке: номер задачи, текст задачи, краткое условие задачи, решение, ответ
- текст, формулы, пояснения к задачам напишите разборчиво (интервал между строчками 1 клетка)
- в конце работы укажите список использованных информационных источников, дату выполнения, вашу подпись
Тема «Химический эквивалент»
Рассчитайте массу (или объем) продуктов реакции, если прореагировало указанное количество моль эквивалентов одного из веществ, при нормальных условиях.
| Номер задачи | Химическая реакция | Количество моль эквивалентов исходного вещества |
| 1.1 | Zn + H2SO4 = ZnSO4 +H2 | 0,2 моль Zn |
| 1.2 | Н2О2 + О3 = Н2О + 2О2 | 0,3 моль О3 |
| 1.3 | 4 FeS2 + 11O2 = 2Fe2O3 + 8SO2 | 1 моль О2 |
| 1.4 | Сu(OH)2 + HCl = CuOHCl +H2O | 0,5 моль НCl |
| 1.5 | Сu(OH)2 + 2HCl = CuCl2 + 2H2O | 0,5 моль НCl |
| 1.6 | H2SO4 + 2KOH = K2SO4 + 2 H2O | 4 моль КОН |
| 1.7 | 2SO2 +O2 = 2 SO3 | 0,1 моль О2 |
| 1.8 | CO + H2O = CO2 + H2 | 2 моль Н2О |
| 1.9 | N2 + O2 = 2 NO | 3 моль N2 |
| 1.10 | 2 H2 + O2 = 2 H2O | 0,6 моль Н2 |
| 1.11 | Fe2O3 + 3H2 = 2 Fe + 3 H2O | 0,4 моль Н2 |
| 1.12 | 2 H2O2 = 2H2O + O2 | 0,1 моль Н2О2 |
| 1.13 | 3 H2 + N2 = 2 NH3 | 3 моль Н2 |
| 1.14 | N2O4 = 2 NO2 | 1 моль N2O4 |
| 1.15 | NH4NO3 = N2O↑ + 2H2O | 0,5 моль NH4NO3 |
| 1.16 | 4 HCl + O2 = 2Cl2 + 2H2O | 0,4 моль О2 |
| 1.17 | SO2 + 2H2 = S + 2H2O | 0,5 моль Н2 |
| 1.18 | NH4NO3 = 4 H2O + O2 + 2N2 | 0,2 моль NH4NO3 |
| 1.19 | 4 NH3 +3 O2 = 2N2 +6H2O | 3 моль О2 |
| 1.20 | 4 NH3 +5 O2 = 4NO +6H2O | 5 моль О2 |
| 1.21 | Аs2O3 + 3H2O = 2 As(OH)3 | 2 моль Н2О |
| 1.22 | PbO2 + H2 = PbO + H2O | 0,6 моль PbO2 |
| 1.23 | NaH + H2O = NaOH + H2 | 0,4 моль Н2О |
| 1.24 | 2 PbS + 3 O2 = 2 PbO + 2 SO2 | 0,3 моль О2 |
| 1.25 | Na2CO3 + SiO2 = Na2SiO3 + CO2 | 2 моль SiO2 |
| 1.26 | H2 + Cl2 = 2 HCl | 0,5 моль Сl2 |
| 1.27 | СaH2 + 2 H2O = 2H2 + Ca(OH)2 | 0,7 моль Н2О |
| 1.28 | 2 ZnS + 3 O2 = 2 ZnO + 2 SO2 | 3 моль О2 |
| 1.29 | 2 SO2 + O2 = 2 SO3 | 2 моль SO2 |
| 1.30 | CS2 + 3 O2 = CO2 + 2 SO2 | 6 моль О2 |
Тема «Строение атома и периодическая система элементов Д.И. Менделеева»
Ответьте на следующие вопросы (см. таблицу):
1. запишите краткую электронную конфигурацию по порядковому номеру в периодической системе элементов;
2. укажите квантовые числа формирующего электрона для элемента с символом;
3. назовите аналоги электронной структуры элемента по формирующему электрону;
4. какова окислительно-восстановительная способность относительно водорода (Н) атомов элемента (для ответов рекомендуется использовать таблицу относительной электроотрицательности элементов и периодическую систему элементов)
| Номер задачи | Вопрос | |||
| 2.1 | Pt | 5р6 | F | |
| 2.2 | Fe | 4f7 | Ва | |
| 2.3 | Xe | 2s1 | La | |
| 2.4 | Mo | 3d5 | Te | |
| 2.5 | Pu | 6р1 | Be | |
| 2.6 | Ti | 4s2 | S | |
| 2.7 | Am | 5d1 | Se | |
| 2.8 | Fr | 2р2 | Mn | |
| 2.9 | Mn | 5f14 | Mg | |
| 2.10 | Ru | 4d3 | Сl | |
| 2.11 | Sc | 6s2 | С | |
| 2.12 | Y | 2р3 | Sr | |
| 2.13 | Zr | 3d2 | I | |
| 2.14 | At | 6s1 | Y | |
| 2.15 | Th | 6р3 | Cr | |
| 2.16 | Mg | 3d10 | N | |
| 2.17 | Ва | 2р4 | Br | |
| 2.18 | U | 7s2 | Hf | |
| 2.19 | Hg | 5f7 | Rb | |
| 2.20 | Pb | 4d9 | Ti | |
| 2.21 | Сl | 3р4 | W | |
| 2.22 | Сs | 3s1 | В | |
| 2.23 | Ро | 3d8 | К | |
| 2.24 | La | 5d4 | О | |
| 2.25 | Hf | 6р1 | Са | |
| 2.26 | Ge | 4d7 | P | |
| 2.27 | Сf | 3s2 | As | |
| 2.28 | Rn | 4d5 | Аl | |
| 2.29 | Si | 2р2 | Si | |
| 2.30 | K | 4s1 | Se |
Тема «Химическая связь»
1. покажите распределение валентных электронов по орбиталям для каждого атома в рассматриваемых молекулах;
2. определите механизм образования связи и ее вид;
3. определите полярность связи (для ответа рекомендуется использовать таблицу относительной электроотрицательности элементов);
4. укажите, имеет ли место гибридизация, ее тип;
5. покажите геометрическую структуру молекул;
6. определите полярность молекул.
| Номер задачи | Молекула | Номер задачи | Молекула | Номер задачи | Молекула |
| 3.1 | Н2S, TeF6 | 3.11 | Br2, SnH4 | 3.21 | NH3, HClO2 |
| 3.2 | AlBr3, H2Te | 3.12 | PF5, PbCl2 | 3.22 | BBr3, PbCl4 |
| 3.3 | GeH4, AsH3 | 3.13 | MgCl2, SF6 | 3.23 | I2, NiCl2 |
| 3.4 | GaI3, HCl | 3.14 | СF4, SO2 | 3.24 | SBr6, CS |
| 3.5 | BeBr2, SbBr3 | 3.15 | CO, BI3 | 3.25 | HCN, CS2 |
| 3.6 | SeF6, FeCl2 | 3.16 | HBr, SiF4 | 3.26 | NF3, CoCl2 |
| 3.7 | SClF5, LiH | 3.17 | AsF5, HNO3 | 3.27 | SbH3, CO2 |
| 3.8 | SiCl2, GaBr3 | 3.18 | GeCl2, SiO2 | 3.28 | PH3, GaI3 |
| 3.9 | PbCl4, HClO4 | 3.19 | SbCl5, SnH2 | 3.29 | OF2, BCl3 |
| 3.10 | SiCl4, H2SO4 | 3.20 | ССl4, H2O | 3.30 | PCl3O, BeH2 |
Тема «Энергетические эффекты химических реакций»
(для ответов рекомендуется использовать справочный материал: Термодинамические характеристики некоторых веществ при 298 К)
4.1 Прямая или обратная реакция будет протекать при стандартных условиях в системе. Ответ подтвердите расчетами. 2 NO + O2 = 2 NO2
4.2 Сколько теплоты выделится при сгорании глюкозы массой 1 г, если реакция протекает по уравнению: С6Н12О6 (к) + 6О2 (г) = 6 СО2 (г) + 6 Н2О (ж); ∆Н0 = -2816 кДж
4.3 По известным теплотам образования веществ (справочн) вычислите теплоту реакции N2 (г) +3Н2 (г) =2NH3
4.4 При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж тепла. Напишите термохимическое уравнение реакции, в результате которого образуются пары воды и диоксид углерода.
4.5 Вычислите сколько теплоты выделится при сгорании 112л СО, если реакция протекает по уравнению: 2 СО (г) + О2 (г) =2 СО2 (г)
4.6 Даны три уравнения химических реакций
Са(тв) + 2 Н2О (ж) = Са(ОН)2(водн) +Н2 (г) + 109 ккал
СаО(тв) +Н2О(ж) = Са(ОН)2 (водн) + +19,5 ккал
Н2(г) +½О2(г) =Н2О(ж) + 68,3 ккал
Определите тепловой эффект реакции Са(тв) + ½ О2(г) =СаО(тв) +Q
4.7 Определите теплоту образования аммиака, исходя из реакции
2NH3 (г) + 1,5О2 (г) = N2 (г) + 3 Н2О(ж) ; ∆Нх.р. = -766 кДж/моль
4.8 Какая из приведенных реакций протекает самопроизвольно. Ответ подтвердите расчетами. 2CuO (к) +4NO2(г) +О2(г) =2 Cu(NO3)2(к)
Н2 (г) + Сl2 (г) = 2НСl (г)
4.9 Определите тепловой эффект реакции: 2 PbS + 3 O2 = 2 PbO + 2 SO2, зная стандартные значения энтальпии веществ (справочн).
4.10 По известным теплотам образования веществ (справочн) вычислите теплоту реакции
2 SO2(г) + O2(г) = 2 SO3(г)
4.11 Какой из отрезков на диаграмме соответствует тепловому эффекту реакции? Экзо- или эндотермическая реакция рассматривается на рисунке. Ответ поясните.


4.12 Определите теплоту перехода графита в алмаз, если известно, что теплота образования СО2 из графита равна -393,5 кДж/моль, а из алмаза -395,4кДж/моль
4.13 По известным теплотам образования веществ (справочн) вычислите теплоту реакции
Fe2O3 (к) +3С (графит) = 2 Fe (к) + 3СО(г)
4.14 Вычислите теплоту образования оксида меди (II), зная, что при восстановлении 40 г его углем образуется оксид углерода (II) и поглощается 10,92 кДж; ∆Н(СО) =-110кДж/моль
4.15 Какая из приведенных реакций протекает самопроизвольно: N2O4 = 2 NO2 или Н2 (г) +I 2 (г) = 2НI (г). Ответ подтвердите расчетами.
4.16 Определите, экзо- или эндотермической является следующая реакция:
2 SО2 (г) + О2 (г) = 2 SO3 (г)
4.17 По известным теплотам образования веществ (справочн) вычислите теплоту реакции
2 H2S (г) +SO2 (г) = 3 S (к) +2 Н2О (г)
4.18 При разложении 0,5 моль СО2 поглощается 196,7 кДж, какова теплота образования СО2?
4.19 Даны три уравнения химических реакций
2 РН3(г) + 4О2(г) = Р2О5(г) + 3 Н2О(ж) + 2440 кДж
Р(тв) + О2(г) = Р2О5(г) +1548 кДж
Н2(г) +½О2(г) = Н2О(ж) + 286 кДж
Определите теплоту образования фосфина РН3.
4.20 По известным теплотам образования веществ (справочн) вычислите теплоту реакции CaSO4(к) +CO2(г) =CaCO3(к) +SO3(г)
4.21 Разложение нитрата аммония возможно по двум схемам: NH4NO3 = N2O + 2 H2O NH4NO3 = N2 + ½ O2 + 2 H2O. Какая из реакций более вероятна? Ответ подтвердите расчетами
4.22 Для каких веществ теплоты образования равны 0: Салмаз; СаСО3; О2; СаО; SO2; Сграфит; Na; I2 (крист); Br2 (жид).
4.23 Известно, что при растворении 1 моль Na2CO3 в воде выделяется 25,1кДж теплоты, а при растворении 1 моль кристаллогидрата Na2CO3 ∙ 10 Н2О поглощается 66,94 кДж теплоты. Вычислите теплоту гидратации соли.
4.24 Реакция горения сероуглерода идет по уравнению: СS2 + 3 O2 = CO2 + 2 SO2. При получении 4,48 л СО2, измеренных при нормальных условиях, выделяется 223 кДж тепла. Вычислите тепловой эффект реакции.
4.25 Сколько кДж теплоты выделяется при взаимодействии 4,6 г натрия с 4,8 г серы (теплота образования Na2S равна 372 кДж/моль)
4.26 Что происходит с энтропией (увеличивается, уменьшается, остается постоянной) в ходе реакции 2 ZnS (к) +3 O2 (г) = 2 ZnO (тв) + 2 SO2 (г) . Ответ поясните.
4.27 Определите теплоту образования фосфина из уравнения реакции 2РН3 + 4О2 = Р2О5 + 3Н2О; ∆Нх.р. =-2440 кДж
4.28 Какая из приведенных реакций протекает самопроизвольно. Ответ поясните расчетами.
НСl (г) + O2 = 2 H2O + Cl2
N2 + 2 O2 = 2 NO2
4.29 Определите теплоту образования хлорида аммония, если для реакции
NH3(г) + HCl(г) =NH4Cl (г); ∆Нх.р.= -176 кДж
4.30 По известным теплотам образования веществ (справочн.) вычислите теплоту реакции
2 КСlO3 (кр) = 2 КСl (кр) + 3 О2 (г)
Тема «Химическое равновесие и кинетика химических реакций»
5.1 Напишите константу равновесия реакции2 S(к) + 2 Н2О(г) =О2(г) +2 Н2S(г). В какую сторону сместиться равновесие при увеличении давления в системе, при уменьшении концентрации Н2S? Как изменится скорость реакции при уменьшении давления в системе в 2 раза?
5.2 В реакторе объемом 50л помещено 72г Н2О и 84г СО. После нагревания до некоторой температуры в системе возникло равновесие Н2О (г) + СО (г) = Н2 (г) +СО2(г), а количество СО2 составило 44г. Рассчитайте константу равновесия Кр.
5.3 В каком направлении будет смещаться равновесие с повышением температуры и давления для реакции: 2 SO2 + O2 = 2 SO3; ∆Нх.р. = -196,6 кДж. Вычислите равновесную концентрацию SO2 и O2, если их исходные концентрации соответственно равны 8 моль/л и 6 моль/л, а [SO3]равн = 4 моль/л
5.4 Напишите константу равновесия реакции 2Н2(г) + СО (г) = СН3ОН (г). Назовите условия для смещения равновесия в сторону прямой реакции. Как изменится скорость реакции при уменьшении давления в системе в 2 раза?
5.5 Напишите константу равновесия реакции N2O4 (г) = 2NO2 (г); ∆Нх.р. =+58,4 кДж. В какую сторону сместиться равновесие при понижении температуры, при понижении давления? Как изменится скорость реакции при увеличении давления в системе в 3 раза?
5.6 При некоторой температуре в гомогенной системе АВ = А + В установилось равновесие с Кр= 0,03. Определите равновесные концентрации, если в начале реакции в реакторе объемом 10л находилось 5 моль АВ.
5.7 Константа равновесия реакции 2NO2 = N2O4 равна 0,25. Определите равновесные концентрации веществ, если исходная концентрация NO2 равна 4 моль/л.
5.8 Вычислите равновесные концентрации исходных веществ в системе СО(г) + ½О2(г) = СО2(г), если начальные концентрации СО и О2 составляли по 0,32 моль/л, а равновесная концентрация [СО2] = 0,12 моль/л. Начальная концентрация СО2 =0.
5.9 Выведите константу равновесия для обратимой реакции: Fe2O3 (к) +СО (г) = 2 FeO(к) +СО2(г). Найдите равновесные концентрации [СО]равн и [CO2]равн, если в реактор объемом 20 л было введено 10 моль СО, а константа равновесия при 10000С равна 0,5
5.10 Напишите константу равновесия реакции Н2 (г) + F2 (г) = 2HF(г). Назовите условия для смещения равновесия в сторону прямой реакции. Как изменится скорость реакции при увеличении давления в системе в 4 раза?
5.11 При некоторой температуре в реакторе объемом 20 л установилось равновесие 2HBr(г) = H2(г) + Br2(г) с Кр=1,13. Определите количество разложившегося HBr, если в начале реакции в реактор было помещено 162г HBr.
5.12 В какую сторону сместиться химическое равновесие реакции N2 + 2 O2 = 2NO2 + Q; если давление увеличить в 3 раза, а температуру на 200С? Температурный коэффициент скорости прямой реакции равен 2, а обратной 3.
5.13 При взаимодействии оксида углерода (II) с хлором исходная концентрация хлора равнялась концентрации оксида углерода (II): 0,1 моль/л. Через некоторое время она стала равной 0,04 моль/л. Во сколько раз уменьшилась скорость реакции к концу этого промежутка времени?
5.14 Напишите константу равновесия реакции СНСl3(г) +Сl2(г)= ССl4(г) + HCl(г). В какую сторону сместиться равновесие при уменьшении давления в системе, при удалении СCl4? Как изменится скорость реакции при увеличении концентрации исходных веществ в системе в 4 раза.
5.15 В реакции N2(г) +3 H2(г) = 2 NH3(г), в состоянии равновесия концентрации веществ были следующие: N2=0,1 моль/л; Н2=0,3 моль/л; NH3 =0,4 моль/л. Вычислите исходные концентрации азота и водорода.
5.16 Для реакции Н2 + Сl2 = 2НСl константа равновесия равна 4. Определите равновесные концентрации веществ, если исходные концентрации Н2 и Сl2 соответственно равны 5 моль/л; 4 моль/л.
5.17 Константа равновесия реакции СuO +СО = Cu + СО2 при 7000С равна 0,5. Вычислите равновесные концентрации СО и СО2, если в реактор объемом 100л было введено 5 моль СО.
5.18 Напишите константу равновесия реакции С4Н8 (г) + Н2 (г) = С4Н10 (г). Назовите условия для смещения равновесия в сторону прямой реакции. Как изменится скорость реакции при уменьшении концентрации [С4Н8] в2 раза, [Н2] в 3 раза?
5.19 Некоторая реакция проводится при 500С, принимая температурный коэффициент скорости реакции равным 2,5; рассчитайте до какой температуры нужно понизить систему, чтобы скорость реакции уменьшилась в 10 раз.
5.20 Чему равна средняя скорость реакции А+В=С, если начальная концентрация вещества В составляла 0,84 моль/л; а через 20с стала равной 0,62 моль/л?
5.21 Напишите константу равновесия реакции 2SO2 (г) + O2 (г) = 2 SO3(г), ∆Нх.р. = - 196,6 кДж. В какую сторону сместиться равновесие при повышении температуры и давления в системе? Как изменится скорость реакции при понижении давления в системе в 4 раза?
5.22 В сосуде объемом 10 л находится 12,8г йодоводорода. После нагревания до некоторой температуры по реакции 2HI(г) = H2(г) + I2(г) образовалось 5,12г йода. Рассчитайте константу равновесия Кр.
5.23 Напишите константу равновесия реакции PCl5(г) = PCl3(г) + Cl2(г); ∆Hх.р = 92,45 кДж. В какую сторону сместиться равновесие при повышении температуры в системе, при увеличении концентрации PCl5? Как изменится скорость реакции при увеличении концентрации PCl5 в 3 раза?
5.24 Константа скорости реакции Н2 + I2 = 2HI при температуре 2830С равна 1,19∙10-4, а при температуре 5080С она равна 3,58. Определите, во сколько раз возрастет скорость реакции?
5.25 В системе СО(г) + Cl2(г) = СОCl2 (г); начальные концентрации СО и Cl2 были соответственно равны 0,28 моль/л и 0,09 моль/л; равновесная концентрация СОСl2 равна 0,02 моль/л. Найдите константу равновесия.
5.26 Напишите выражение константы равновесия реакции: Na2S2O3(ж) +H2SO4(ж) = Na2SO4(ж) + H2SO4(ж) + H2SO3(ж) + S(тв). Как изменится скорость реакции, если регулирующую смесь разбавить в два раза?
5.27 Для некоторой температуры константа равновесия реакции СО + Н2О = СО2 + Н2 равна единице. Вычислите равновесные концентрации веществ в момент равновесия, если исходные концентрации СО и Н2О соответственно равны 0,1 и 0,4 моль/л.
5.28 Вычислите равновесные концентрации N2 и О2 в реакции N2 + O2 =2NO, если начальные концентрации были равны: [N2] = 0,049 моль/л; [O2] =0,01 моль/л, а в момент равновесия концентрация NO стала равной 0,005 моль/л.
5.29 Напишите константу равновесия реакции 2НBr (г) =H2 (г) +Br2 (г), ∆Нх.р = +72,5 кДж. Назовите условия для смещения равновесия реакции в сторону прямой реакции. Как изменится скорость реакции при увеличении давления в системе в 3 раза?
5.30 При некоторой температуре в системе PCl3(г) + Cl2(г) = PCl5(г) в системе установилось равновесие: [Cl2] =0,01 моль/л; [PCl3]= 0,02 моль/л; [PCl5] = 0,02 моль/л. Какими будут равновесные концентрации, если концентрацию хлора увеличить до 0,05 моль/л?
Тема «Растворы»
1. Из четырех веществ номера вашей задачи (см. столбцы 1-4) выберите сильные и слабые электролиты и составьте уравнения диссоциации их в водном растворе
2. В столбце 1а даны значения молярных концентраций для растворов электролитов из столбца 1. Зная молярную концентрацию своего раствора, определите моляльность, нормальность, массовую долю вещества, принимая его плотность равной 1г/см3.
3. Напишите выражение для констант диссоциации слабого электролита по всем возможным ступеням.
4. В столбце 3 приведены малорастворимые электролиты. Напишите выражение для ПР малорастворимого электролита номера вашей задачи
5. Напишите уравнение гидролиза соли, данной в столбце 4, по всем возможным ступеням и выражение для констант гидролиза по этим ступеням.
6. Рассчитайте рН раствора соли из столбца 4, для концентрации указанной в столбце 4а, учитывая только 1-ую ступень гидролиза. Укажите реакцию среды раствора. Определите, как будет изменяться рН раствора при нагревании и почему?
| Номер задачи | Наименование вещества | Концентрация вещества | ||||
| 1а | 4а | |||||
| 6.1 | CsOH | H2C2O4 | SrSO4 | Na2SO3 | 0,002 | 0,03 |
| 6.2 | HBr | HOBr | AgI | Na3BO3 | 0,005 | 0,02 |
| 6.3 | Sr(OH)2 | H3BO3 | MnS | K2S | 0,001 | 0,04 |
| 6.4 | RbOH | НРО3 | PbI2 | Pb(NO3)2 | 0,009 | 0,06 |
| 6.5 | Ca(OH)2 | H2CrO4 | PbCl2 | Al2(SO4)3 | 0,01 | 0,002 |
| 6.6 | Н2SO4 | NH4OH | BaCrO4 | NaNO2 | 0,005 | 0,03 |
| 6.7 | LiOH | Н3РО4 | Са3(РО4)2 | HCOOLi | 0,008 | 0,05 |
| 6.8 | HI | Н2SO3 | СаСО3 | Na2SiO3 | 0,002 | 0,07 |
| 6.9 | Вa(OH)2 | HCN | СаSO4 | K2SO3 | 0,005 | 0,03 |
| 6.10 | HClO4 | NH4OH | MgCO3 | (NH4)2SO4 | 0,01 | 0,05 |
| 6.11 | HCl | H2Se | Ag2SO4 | Na2CO3 | 0,006 | 0,04 |
| 6.12 | NaOH | H2SiO3 | BaSO4 | FeCl2 | 0,007 | 0,01 |
| 6.13 | KOH | HNO2 | Ag2CrO4 | Ba(NO2)2 | 0,07 | 0,05 |
| 6.14 | HNO3 | HAlO2 | FeS | KNO2 | 0,09 | 0,06 |
| 6.15 | HClO4 | HOCl | NiS | Сa(NO2)2 | 0,02 | 0,002 |
| 6.16 | LiOH | H2CO3 | Ag3PO4 | Na2S | 0,05 | 0,003 |
| 6.17 | Sr(OH)2 | H2SeO3 | ZnS | AlCl3 | 0,008 | 0,04 |
| 6.18 | HI | HF | CaF2 | К2СО3 | 0,02 | 0,005 |
| 6.19 | KOH | H2S | BaCO3 | NH4Cl | 0,05 | 0,001 |
| 6.20 | Ba(OH)2 | H3PO4 | PbSO4 | СrBr3 | 0,006 | 0,02 |
| 6.21 | CsOH | H2SO3 | Sr3(PO4)2 | Zn(NO3)2 | 0,001 | 0,05 |
| 6.22 | Сa(OH)2 | HCN | FeCO3 | NiSO4 | 0,006 | 0,09 |
| 6.23 | H2SO4 | HAlO2 | СdS | NaHCO3 | 0,003 | 0,03 |
| 6.24 | HBr | HMnO4 | СoSO3 | Al2(SO4)3 | 0,02 | 0,006 |
| 6.25 | RbOH | HF | MgF2 | NH4Br | 0,009 | 0,07 |
| 6.26 | NaOH | HOCl | SrSO4 | Ni(NO2)2 | 0,01 | 0,009 |
| 6.27 | LiOH | H3BO3 | AgI | Сu(СN)2 | 0,007 | 0,04 |
| 6.28 | HCl | H2TeO3 | Сa3(PO4)2 | K2Se | 0,04 | 0,008 |
| 6.29 | HClO4 | H2Te | AgBr | Na2Te | 0,008 | 0,03 |
| 6.30 | HNO3 | NH4OH | PbCl2 | KCN | 0,02 | 0,007 |
Тема «Способы выражения концентрации»
7.1 Какой объем 2М НСl потребуется для нейтрализации 14 г КОН, содержащихся в 1л растворе?
7.2 К 600 г раствора NaOH с массовой долей 15% прибавили 0,5л воды. Какова массовая доля NaOH в новом растворе?
7.3. Определите массовую долю раствора, полученного при смешивании 100 мл раствора Н2SO4 c массовой долей 40% (ρ = 1,303 г/см3) и 500 мл 0,5 М раствора Н2SO4 (ρ = 1,07 г/см3)
7.4. Сколько граммов карбоната натрия надо прибавить к 200 г 10%-го раствора Na2CO3, чтобы получить 20%-ный раствор?
7.5 Сколько граммов воды надо удалить путем выпаривания, чтобы из 150 г 10%-го раствора карбоната калия получить 30%-ный раствор этой соли?
7.6. Рассчитайте массу воды, необходимую для приготовления 250г раствора с массовой долей карбоната натрия 28%.
7.7 В воде растворили 11,2 г гидрооксида калия, объем раствора довели до 257 мл. Определите молярную концентрацию раствора.
7.8 Сколько граммов NaCl содержится в 750 мл 10%-го раствора, плотность которого 1,063г/мл?
7.9. К 150 г 5%-го раствора поваренной соли добавили 15г хлорида натрия. Рассчитайте массовую долю NaCl в новом растворе.
7.10 Смешали 250г 10%-го раствора и 750г 15%-го раствора хлорида натрия. Вычислите массовую долю NaCl в новом растворе.
7.11. 1 мл 25%-го раствора содержит 0,458 г растворенного вещества. Какова плотность этого раствора?
7.12. Имеется 30%-ный раствор азотной кислоты (плотность 1,2г/мл). Какова молярная концентрация этого раствора?
7.13. Растворимость хлорида натрия при 250С равна 36,0 г в 100 г воды. Определите массовую долю соли в насыщенном растворе при этой температуре.
7.14.Упарили вдвое (по объему) 2 л 10%-го раствора хлорида натрия (плотность 1,07 г/мл). Определите молярную концентрацию полученного раствора.
7.15 Какова будет массовая доля азотной кислоты в растворе, если к 40 мл 96%-го раствора HNO3 (плотность 1,5г/мл) прилить 30 мл 48%-го раствора HNO3 (плотность 1,3 г/мл)?
7.16. Какую массу медного купороса CuSO4∙5H2O и воды надо взять для приготовления 40 кг 20%-го раствора сульфата меди (II)?
7.17 Рассчитайте объем концентрированной хлороводородной кислоты (плотность 1,19 г/мл), содержащей 38% хлороводорода, необходимый для приготовления 1л 2М раствора.
7.18. Сколько граммов воды надо удалить путем выпаривания, чтобы из 200 г 20%-го раствора сульфата калия получить 30%-ный раствор этой соли?
7.19. Молярная концентрация серной кислоты в растворе равна 11,7 моль/л, а плотность раствора составляет 1,62г/мл. Какова массовая доля серной кислоты в этом растворе?
7.20. Сколько граммов гидрооксида натрия надо добавить к 200 г воды, чтобы получить 20%-ный раствор NaOH?
7.21. Во врачебной практике применяют 5%-ный раствор CaCl2. Вычислите сколько граммов CaCl2∙6Н2О необходимо взять для приготовления 2 кг раствора указанной концентрации.
7.22. Плотность 10,85%-го раствора карбоната натрия 1,116г/мл. Вычислите содержание Na2CO3∙10H2O в растворе объемом 1л.
7.23.Какую массу кристаллической соды Na2CO3∙10H2O надо взять для приготовления 500г раствора c массовой долей Na2CO3 20%?
7.24. Найти массу воды и медного купороса CuSO4∙5H2O, необходимых для приготовления 1л раствора, содержащего 8% безводной соли. Плотность 8%-го раствора равна 1,084г/мл.
7.25. В колбу налили 200 мл 72%-го раствора серной кислоты с плотностью 1,64г/мл. Вычислите количество моль серной кислоты в колбе.
7.26. Какую массу воды и кристаллогидрата FeSO4∙7H2O нужно взять для приготовления раствора массой 300 г с массовой долей FeSO4 25%?
7.27.Сколько граммов Н3РО4 надо прибавить к 200 г воды, чтобы получить 20%-ный раствор Н3РО4?
7.28. Сколько граммов йода и спирта нужно взять для приготовления 500 г 5%-ной йодной настойки?
7.29. Какая масса NaCl необходима для приготовления 5л физиологического раствора (0,9%, ρ=,01г/мл)?
7.30 Сколько граммов вещества надо добавить к 100г его 10%-го раствора, чтобы получить 20%-ный раствор?
Тема «Окислительно –восстановительные реакции»
Подберите коэффициенты электронно-ионным методом, укажите окислитель и восстановитель.
| Номер задачи | Уравнение окислительно-восстановительной реакции |
| 8.1 | 
|
| 8.2 | 
|
| 8.3 | 
|
| 8.4 | 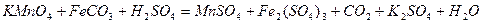
|
| 8.5 | 
|
| 8.6 | 
|
| 8.7 | 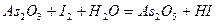
|
| 8.8 | 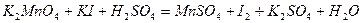
|
| 8.9 | 
|
| 8.10 | 
|
| 8.11 | 
|
| 8.12 | 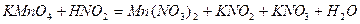
|
| 8.13 | 
|
| 8.14 | 
|
| 8.15 | 
|
| 8.16 | 
|
| 8.17 | 
|
| 8.18 | 
|
| 8.19 | 
|
| 8.20 | 
|
| 8.21 | 
|
| 8.22 | 
|
| 8.23 | 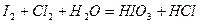
|
| 8.24 | 
|
| 8.25 | 
|
| 8.26 | 
|
| 8.27 | 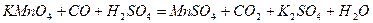
|
| 8.28 | 
|
| 8.29 | 
|
| 8.30 | 
|
Тема «Свойства элементов»
Ответьте на следующие вопросы (см. таблицу):
1. Нахождение в природе и получение в свободном виде
2. Положение в периодической системе, электронная конфигурация атома, графическое изображение валентных электронов нормальном и возбужденном состояниях, валентность, примеры соединений в устойчивых степенях окисления
3. Физические и химические свойства элемента
4. Свойства соединений
5. Роль в жизнедеятельности человека
| Номер задачи | Элемент | Номер задачи | Элемент | Номер задачи | Элемент |
| 9.1 | С | 9.11 | Cl | 9.21 | Мо |
| 9.2 | N | 9.12 | К | 9.22 | Ag |
| 9.3 | О | 9.13 | Са | 9.23 | Au |
| 9.4 | F | 9.14 | Мn | 9.24 | I |
| 9.5 | Na | 9.15 | Fe | 9.25 | Сr |
| 9.6 | Mg | 9.16 | Co | 9.26 | As |
| 9.7 | Al | 9.17 | Ni | 9.27 | В |
| 9.8 | Si | 9.18 | Сu | 9.28 | Sn |
| 9.9 | S | 9.19 | Zn | 9.29 | Рt |
| 9.10 | Р | 9.20 | Br | 9.30 | Pb |
Тема «Основные классы неорганических соединений»
Составьте уравнения реакций, протекающих в цепи превращений; укажите условия протекания реакций; дайте название исходным веществам и продуктам химических реакций
| Номер задачи | Цепочка превращений |
| 10.1 | NaCl → Na2CO3 → NaHCO3 → NaCl → Na |
| 10.2 | FeS2 → SO2 → SO3 →CaSO4 → Ca(HSO4)2 |
| 10.3 | Ca → CaO → Ca(OH)2 →CaCO3 → Ca(HCO3)2 →CO2 |
| 10.4 | KOH → KAlO2 → Al(OH)3 →Al2O3 →AlPO4 |
| 10.5 | Al → Al(OH)3→ Al2O3 → Al →Al2S3 →AlCl3 |
| 10.6 | K2CO3 →K2SO4 →KCl → Cl2 →CaCl2 |
| 10.7 | Fe →FeS →FeCl2 →FeCl3 →Fe(OH)3→Fe2O3 |
| 10.8 | Ca →CaCl2 →Ca(OH)2 →Ca(NO3)2 →CaCl2 |
| 10.9 | Na2CO3 →NaCl → NaOH →NaHCO3 →CO2 |
| 10.10 | Zn →ZnS →ZnCl2 →ZnO →ZnSO4 → Zn(OH)2 |
| 10.11 | Cu →Cu(NO3)2 →CuO →Cu SO4 →Cu →Cu(OH)2 |
| 10.12 | Ca → CaO → Ca(NO3)2 → Ca(OH)2→ CaSiO3 |
| 10.13 | Na → NaCl →Na2CO3 →NaHCO3 →Na2CO3 |
| 10.14 | O2→ SiO2→ Si → Mg2Si → SiH4 |
| 10.15 | N2 → NH3 → HNO3 →Mg(NO3)2→Мg |
| 10.16 | (NH4)2Cr2O7 →Cr2O3 → NaCrO2 →Cr2(SO4)3→Cr |
| 10.17 | HCl → Cl2 →KClO3 →KCl → AgCl |
| 10.18 | Fe2O3 ↔Fe(OH)3 → Fe2(SO4)3 → Fe → FeCl2 |
| 10.19 | FeS2 → Fe(OH)3 →Fe(SO4)3 →FeCl3 →Fe2O3 |
| 10.20 | Pb(NO3)2 → HNO3 → NH4NO3 → N2 → NH3 |
| 10.21 | Ca3(PO4)2 →Ca(H2PO4)2 → CaSO4 → CaS →CaCO3 |
| 10.22 | NH3 → NH4Cl → HCl→ Cl2→ KClO3 |
| 10.23 | NaNO3 →NaNO2 → N2 → NO→Ba(NO3)2 |
| 10.24 | Na2SO3 → S → Al2S3 → H2S →SO2 |
| 10.25 | Pb(NO3)2 → HNO3 →NH4 NO3 →N2O |
| 10.26 | Ba(NO3)2 →BaCl2 →BaSO4 →BaS →H2S →S |
| 10.27 | KNO3 →KCl → KClO3 → KCl → K2SO4 |
| 10.28 | KClO3 →KCl →HCl → CaCl2 →CaSO4 |
| 10.29 | FeS2 → H2SO4 → SO2 → KHSO3 |
| 10.30 | NH4Cl → NH4 NO3 → NH3 → NO →Fe(NO3)3 |
Вопросы для подготовки к экзамену:
1. Основные представления о строении атома. Модель атома по Э.Резерфорду. Теория Н.Бора. Основные элементарные частицы атома.
2. Квантово-механическая модель атома водорода. Понятие об орбиталях.
3. Квантовые числа: главное, орбитальное, магнитное, спиновое. Их физический смысл и взаимосвязь.
4. Электронная конфигурация многоэлектронных атомов. Принцип Паули, правило Гунда, правило Клечковского, принцип минимальной энергии.
5. Периодическая система элементов Д.И. Менделеева и периодические свойства элементов: энергия ионизации, сродство к электрону, электроотрицательность, атомный радиус.
6. Определение и характеристики химической связи: энергия связи, длина связи, валентные углы.
7. Ковалентная связь. Полярность связи. Донорно-акцепторный и обменный механизмы образования связи.
8. Основные положения метода валентных связей. Валентность. Направленность, насыщаемость связи.
9. Валентные электроны атомов s- , p- , d-, f – семейств. Валентность атома в нормальном и возбужденном состояниях. Степень окисления.
10. Пространственная структура молекул. Кратность связи. σ- и π-связь.
11. Гибридизация атомных орбиталей. Пространственная конфигурация молекул.
12. Термодинамические функции: внутренняя энергия, энтальпия, энтропия и энергия Гиббса.
13. Первый закон термодинамики. Теплота и работа.
14. Тепловой эффект реакции. Закон Гесса.
15. Второй закон термодинамики.
16. Условие самопроизвольного протекания химических реакций. Энтропийный и энтальпийный факторы. Условие термодинамического равновесия.
17. Химическое равновесие. Константа химического равновесия. Закон действующих масс. Принцип Ле Шателье.
18. Скорость химической реакции. Зависимость скорости реакции от концентрации и температуры. Правило Вант-Гоффа.
19. Особенности каталитических реакций. Катализаторы.
20. Растворы. Процесс растворения. Теория электролитической диссоциации. Степень электролитической диссоциации. Сильные и слабые электролиты.
21. Кислоты, основания, соли с точки зрения электролитической диссоциации. Константа диссоциации.
22. Ионные реакции обмена в растворах электролитов. Произведение растворимости.
23. Электролитическая диссоциация воды, ионное произведение воды. Водородный показатель. Индикаторы.
24. Гидролиз солей.
25. Окислительно-восстановительные реакции. Важнейшие окислители и восстановители с точки зрения строения атома. Ионно-электронный метод (метод полуреакций) подбора коэффициентов в уравнениях окислительно-восстановительных реакций.
26. Электролиз расплавов и растворов солей.
27. Коррозия металлов и защита металлов от коррозии.
28. Металлы. Положение в Периодической системе, особенности строения их атомов. Строение и физические свойства простых веществ. Аллотропия.
29. Неметаллы. Положение в Периодической системе, особенности строения их атомов. Строение и физические свойства простых веществ. Аллотропия.
30. Химические свойства простых веществ – металлов и неметаллов.
31. Оксиды. Химические свойства кислотных, основных, амфотерных оксидов. Получение оксидов.
32. Гидрооксиды металлов и неметаллов. Химические свойства гидрооксидов. Получение.
33. Соли, состав, классификация. номенклатура. Способы получения солей. Химические свойства солей.
34. Водород. Физические и химические свойства водорода. Соединения водорода. Получение и применение водорода.
35. Физические свойства воды. Строение молекулы воды. Основные химические и физико-химические способы водоподготовки. Обеззараживание.
36. Химия s-, р- металлов. Щелочные металлы, алюминий, олово, свинец. Физические и химические свойства. Свойства соединений. Применение соединений.
37. Основные закономерности химии d-элементов. Физические и химические свойства. Свойства соединений. Применение соединений.
38. Элементы IVA-группы Периодической системы: углерод, кремний, германий, олово, свинец. Физические и химические свойства. Свойства соединений. Применение соединений.
39. Элементы VA-группы Периодической системы: азот, фосфор, мышьяк, сурьма, висмут. Физические и химические свойства. Свойства соединений. Применение соединений.
40. Элементы VIA-группы Периодической системы: кислород, сера, селен, теллур, полоний. Физические и химические свойства. Свойства соединений. Применение соединений.
41. Галогены: фтор, хлор, бром, йод, астат. Физические и химические свойства. Свойства соединений. Применение соединений.
42. Экологические проблемы общества.
Информационные источники:
1. Ахметов Н.С. Общая и неорганическая химия.- М.: Высшая школа, 1998 г.
2. Глинка Н.Л. Общая химия / под ред. В.А.Рабиновича. М.:. Химия, 2005 г.
3. Глинка Н.Л. Задачи и упражнения по общей химии / под ред. В.А.Рабиновича, Х.М.Рубиной. – Л.: Химия, 1986 г.
4. Задачи и упражнения по общей химии: Учеб. пособие/ Под. ред. Н.В.Коровина. – 2-е изд., испр. – М.: Высш. школа, 2004. – 255с.
5. Коровин Н.В. Общая химия: Учеб. для технических направ. и спец. вузов / Н.В.Коровин. 6-е изд., испр. – М.: Высш. школа., 2005. – 557с.
6. Периодическая система химических элементов Д.И.Менделеева; таблица растворимости солей и оснований, ряд электродных потенциалов и др.
7. www.alhimik.ru
8. www.college.ru/chemistry/
9. www.chem.msu.su/rus/
10. www.xumuk.ru/
11. www.chemport.ru
Номера задач по контрольной работе (номер варианта выдается преподавателем)
| Предпоследняя цифра варианта | Последняя цифра варианта | |||||||||
| 1.1; 2.1; 3.1; 4.1; 5.1; 6.1; 7.1; 8.1; 9.1; 10.1 | 1.2;2.2; 3.2; 4.2; 5.2; 6.2; 7.2; 8.2; 9.2; 10.2; | 1.3; 2.3; 3.3; 4.3; 5.3; 6.3; 7.3; 8.3; 9.3; 10.3; | 1.4; 2.4; 3.4; 4.4; 5.4; 6.4; 7.4; 8.4; 9.4; 10.4; | 1.5; 2.5; 3.5; 4.5; 5.5; 6.5; 7.5; 8.5; 9.5; 10.5; | 1.6; 2.6; 3.6; 4.6; 5.6; 6.6; 7.6; 8.6; 9.6; 10.6; | 1.7;2.7; 3.7; 4.7; 5.7; 6.7; 7.7; 8.7; 9.7; 10.7; | 1.8; 2.8; 3.8; 4.8; 5.8; 6.8; 7.8; 8.8; 9.8; 10.8; | 1.9; 2.9; 3.9; 4.9; 5.9; 6.9; 7.9; 8.9; 9.9; 10.9; | 1.10; 2.10; 3.10; 4.10; 5.10; 6.10; 7.10; 8.10; 9.10; 10.10; | |
| 1.11;2.11; 3.11; 4.11; 5.11; 6.11; 7.11; 8.11; 9.11; 10.11; | 1.12; 2.12; 3.12; 4.12; 5.12; 6.12; 7.12; 8.12; 9.12; 10.12; | 1.13; 2.13; 3.13; 4.13; 5.13; 6.13; 7.13; 8.13; 9.13; 10.13; | 1.14;2.14; 3.14; 4.14; 5.14; 6.14; 7.14; 8.14; 9.14; 10.14; | 1.15; 2.15; 3.15; 4.15; 5.15; 6.15; 7.15; 8.15; 9.15; 10.15; | 1.16; 2.16; 3.16; 4.16; 5.16; 6.16; 7.16; 8.16; 9.16; 10.16; | 1.17; 2.17; 3.17; 4.17; 5.17; 6.17; 7.17; 8.17; 9.17; 10.17 | 1.18; 2.18; 3.18; 4.18; 5.18; 6.18; 7.18; 8.18; 9.18; 10.18; | 1.19; 2.19; 3.19; 4.19; 5.19; 6.19; 7.19; 8.19; 9.19; 10.19; | 1.20; 2.20; 3.20; 4.20; 5.20; 6.20; 7.20; 8.20; 9.20; 10.20; | |
| 1.21; 2.21; 3.21; 4.21; 5.21; 6.21; 7.21; 8.21; 9.21; 10.21; | 1.22; 2.22; 3.22; 4.22; 5.22; 6.22; 7.22; 8.22; 9.22; 10.22; | 1.23; 2.23; 3.23; 4.23; 5.23; 6.23; 7.23; 8.23; 9.23; 10.23; | 1.24; 2.24; 3.24; 4.24; 5.24; 6.24; 7.24; 8.24; 9.24; 10.24; | 1.25; 2.25; 3.25; 4.25; 5.25; 6.25; 7.25; 8.25; 9.25; 10.25; | 1.26; 2.26; 3.26; 4.26; 5.26; 6.26; 7.26; 8.26; 9.26; 10.26; | 1.27; 2.27; 3.27; 4.27; 5.27; 6.27; 7.27; 8.27; 9.27; 10.27; | 1.28; 2.28; 3.28; 4.28; 5.28; 6.28; 7.28; 8.28; 9.28; 10.28; | 1.29; 2.29; 3.29; 4.29; 5.29; 6.29; 7.29; 8.29; 9.29; 10.29; | 1.30; 2.30; 3.30; 4.30; 5.30; 6.30; 7.30; 8.30; 9.30; 10.30; | |
| 1.1; 2.1;3.1; 4.1; 5.1; 6.1; 7.1; 8.1; 9.1; 10.1 | 1.2;2.2; 3.2; 4.2; 5.2; 6.2; 7.2; 8.2; 9.2; 10.2; | 1.3; 2.3; 3.3; 4.3; 5.3; 6.3; 7.3; 8.3; 9.3; 10.3; | 1.4; 2.4; 3.4; 4.4; 5.4; 6.4; 7.4; 8.4; 9.4; 10.4; | 1.5;2.5; 3.5; 4.5; 5.5; 6.5; 7.5; 8.5; 9.5; 10.5; | 1.6; 2.6; 3.6; 4.6; 5.6; 6.6; 7.6; 8.6; 9.6; 10.6; | 1.7;2.7; 3.7; 4.7; 5.7; 6.7; 7.7; 8.7; 9.7; 10.7; | 1.8; 2.8; 3.8; 4.8; 5.8; 6.8; 7.8; 8.8; 9.8; 10.8; | 1.9; 2.9; 3.9; 4.9; 5.9; 6.9; 7.9; 8.9; 9.9; 10.9; | 1.10; 2.10; 3.10; 4.10; 5.10; 6.10; 7.10; 8.10; 9.10; 10.10; | |
| 1.11;2.11; 3.11; 4.11; 5.11; 6.11; 7.11; 8.11; 9.11; 10.11; | 1.12; 2.12; 3.12; 4.12; 5.12; 6.12; 7.12; 8.12; 9.12; 10.12; | 1.13; 2.13; 3.13; 4.13; 5.13; 6.13; 7.13; 8.13; 9.13; 10.13; | 1.14;2.14; 3.14; 4.14; 5.14; 6.14; 7.14; 8.14; 9.14; 10.14; | 1.15; 2.15; 3.15; 4.15; 5.15; 6.15; 7.15; 8.15; 9.15; 10.15; | 1.16; 2.16; 3.16; 4.16; 5.16; 6.16; 7.16; 8.16; 9.16; 10.16; | 1.17; 2.17; 3.17; 4.17; 5.17; 6.17; 7.17; 8.17; 9.17; 10.17 | 1.18; 2.18; 3.18; 4.18; 5.18; 6.18; 7.18; 8.18; 9.18; 10.18; | 1.19; 2.19; 3.19; 4.19; 5.19; 6.19; 7.19; 8.19; 9.19; 10.19; | 1.20; 2.20; 3.20; 4.20; 5.20; 6.20; 7.20; 8.20; 9.20; 10.20; | |
| 1.21; 2.21; 3.21; 4.21; 5.21; 6.21; 7.21; 8.21; 9.21; 10.21; | 1.22; 2.22; 3.22; 4.22; 5.22; 6.22; 7.22; 8.22; 9.22; 10.22; | 1.23; 2.23; 3.23; 4.23; 5.23; 6.23; 7.23; 8.23; 9.23; 10.23; | 1.24; 2.24; 3.24; 4.24; 5.24; 6.24; 7.24; 8.24; 9.24; 10.24; | 1.25; 2.25; 3.25; 4.25; 5.25; 6.25; 7.25; 8.25; 9.25; 10.25; | 1.26; 2.26; 3.26; 4.26; 5.26; 6.26; 7.26; 8.26; 9.26; 10.26; | 1.27; 2.27; 3.27; 4.27; 5.27; 6.27; 7.27; 8.27; 9.27; 10.27; | 1.28; 2.28; 3.28; 4.28; 5.28; 6.28; 7.28; 8.28; 9.28; 10.28; | 1.29; 2.29; 3.29; 4.29; 5.29; 6.29; 7.29; 8.29; 9.29; 10.29; | 1.30; 2.30; 3.30; 4.30; 5.30; 6.30; 7.30; 8.30; 9.30; 10.30; |
Дата добавления: 2015-01-05; просмотров: 296; Мы поможем в написании вашей работы!; Нарушение авторских прав |