
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Применение первого начала термодинамики для изотермического процесса. Работа газа при изотермическом процессе.
Изотермический процесс. При изотермическом процессе температура системы не изменяется (ΔТ = 0), а, следовательно, ее внутренняя энергия, являясь для идеального газа только функцией температуры, остается постоянной, то есть ее изменение ΔU = 0. Это значит, что сообщаемое системе количество теплоты идет на совершение работы.
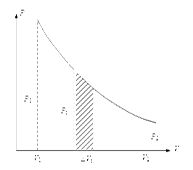 Рис. 4.9 Рис. 4.9
|
Найдем работу расширения моля идеального газа в изотермическом процессе. Изотерма в координатах Р – Vпредставляется гиперболой (рис. 4.9). Как уже было рассмотрено ранее, работу расширения газа от начального объема V1до V2 можно найти, используя равенство (4.17): 
Давление моля идеального газа, как следует из уравнения состояния, равно 
и выражение для работы принимает вид: 
Очевидно, что чем меньшие интервалы изменения объема ΔVi выбираются для вычисления работы, тем точнее будет получено ее значение. Предельный переход в соотношении (4.32) приводит к выражению:
 , ,
|
где V1 и V2 – объемы, занимаемые системой соответственно в начальном и конечном состояниях. Обобщая формулу (4.33) на случай системы, содержащей ν молей газа, получаем равенство: 
Пользуясь уравнением изотермического процесса (PV = const), равенство (4.34) можно представить через другие параметры состояния системы:  где Р1 и Р2 – давление газа в начальном и конечном состояниях.
где Р1 и Р2 – давление газа в начальном и конечном состояниях.
4. Адиабатический процесс. Адиабатический процесс – процесс, идущий без теплообмена с окружающей средой. Это значит, что система должна быть теплоизолирована, либо процесс должен протекать так быстро, что за время процесса не происходит теплообмена системы с окружающей средой. Условие адиабатичности процесса означает, чтоQ = 0.
Уравнение первого закона термодинамики для адиабатического процесса принимает вид: 
Из последнего соотношения следует, что А = – ΔU и для одного моля идеального газа равно 
Из (4.37) очевидно, что если адиабатически изолированная система подвергается сжатию (внешние силы совершают над системой работу, поэтому работа отрицательна), то ΔU > 0. Это означает, что адиабатическое сжатие идеального газа приводит к повышению его температуры. Напротив, адиабатическое расширение идеального газа (работа совершается самой системой, поэтому она положительна) может происходить только за счет уменьшения его внутренней энергии (ΔU < 0), поэтому температура газа при его адиабатическом расширении должна понижаться.Все рассмотренные выше процессы могут быть представлены одним уравнением – уравнением политропического процесса. Политропический процесс – это процесс, идущий с постоянной теплоемкостью. Уравнение
политропического процесса имеет вид  где
где  – показатель политропы.
– показатель политропы.
Уравнения всех рассмотренных процессов, их графики, значения теплоемкости и показатели политропы, а также значения всех величин, входящих в выражение первого закона термодинамики, представлены в таблице 4.1.
Дата добавления: 2015-01-15; просмотров: 800; Мы поможем в написании вашей работы!; Нарушение авторских прав |