
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Адиабатический процесс. Уравнение Пуассона.
Адиабатическим называется процесс, при котором отсутствует теплообмен (δQ=0) между системой и окружающей средой. Адиабатическим процессами можно считать все быстропротекающие процессы. Таковым, например, можно считать процесс распространения звука в среде, так как скорость распространения звуковой волны настолько большая по значению, что обмен энергией между средой и волной произойти не успевает. Адиабатические процессы происходят в двигателях внутреннего сгорания (сжатие и расширение горючей смеси в цилиндрах), в холодильных установках и т. д.
Из первого начала термодинамики (δQ=dU+δA) для адиабатического процесса следует, что 
т. е. внешняя работа совершается за счет изменения внутренней энергии системы.
Используя формулы δA=pdV и CV=dUm/dT, для произвольной массы газа перепишем уравнение (1) в виде 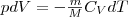
применив дифференцирование уравнение состояния для идеального газа pV=(m/M)RT получим 
Исключим из (2) и (3) температуру Т. 
Разделив переменные и учитывая, что Сp/СV=γ , найдем 
Проинтегрируя это уравнение в пределах от p1 до p2 и соответственно от V1 до V2, и потенцируя, придем к выражению
 или
или 
Так как состояния 1 и 2 выбраны произвольно, то можно записать 
Полученное выражение есть уравнение адиабатического процесса, называемое также уравнением Пуассона.
Для перехода к переменным Т, V или p, Т исключим из (55.4) с помощью уравнения Менделеева-Клапейрона 
соответственно давление или объем:  ,
, 
Выражения представляют собой уравнения адиабатического процесса. В них безразмерная величина 
называется показателем адиабаты (или коэффициентом Пуассона). Для одноатомных газов (Ne, He и др.), достаточно хорошо удовлетворяющих условию идеальности, i=3, γ=1,67. Для двухатомных газов (Н2, N2, О2 и др.) i=5, γ=1,4. Значения γ, вычисленные по формуле (55.7), хорошо подтверждаются экспериментом.
Диаграмма адиабатического процесса (адиабата) в координатах р, V есть гипербола. Адиабата (pVγ = const) более крута, чем изотерма (pV = const) по причине, что при адиабатическом сжатии 1—3 увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры.
 Вычислим работу, которую совершает газ в адиабатическом процессе. Запишем уравнение (1) в виде
Вычислим работу, которую совершает газ в адиабатическом процессе. Запишем уравнение (1) в виде

Если газ адиабатически расширяется от объема V1 до V2, то его температура уменьшается от T1 до T2 и работа расширения идеального газа
 (8)
(8)
Используя те же приемы, что и при выводе формулы (5), выражение (8) для работы при адиабатическом расширении можно привести к виду

где p1V1=(m/M)RT1
Работа, которую совершает газом при адиабатическом расширении 1—2 (определяется площадью, заштрихованной), меньше, чем при изотермическом, по причине, что при адиабатическом расширении осуществляется охлаждение газа, тогда как при изотермическом — температура поддерживается постоянной за счет притока извне такого же количества теплоты.
Рассмотренные изобарный, изохорный, изотермический и адиабатический процессы имеют общую особенность — они происходят при постоянной теплоемкости. В первых двух процессах теплоемкости соответственно равны СV и Сp, в изотермическом процессе (dT=0) теплоемкость равна ±∞, в адиабатическом (δQ=0) теплоемкость равна нулю. Процесс, в котором теплоемкость остается неизменной, называется политропным.
Исходя из первого начала термодинамики при условии постоянства теплоемкости (C=const) можно вывести уравнение политропы:
 (9)
(9)
где n=(С—Сp)/(С—СV)—показатель политропы. Очевидно, что при С=0, n=γ, из (55.9) получается уравнение адиабаты; при С = 0, n = 1 — уравнение изотермы; при С=Сp, n=0 —уравнение изобары, при С=СV, n=±∞ — уравнение изохоры. Таким образом, все рассмотренные процессы являются частными случаями политропного процесса.
Дата добавления: 2015-01-15; просмотров: 631; Мы поможем в написании вашей работы!; Нарушение авторских прав |