
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Третье начало термодинамики. Теорема Нернста.
Первое и второе начала термодинамики не позволяет определить значение энтропии при абсолютном нуле Т = 0 К.
На основании обобщения экспериментальных исследований свойств различных веществ при сверхнизких температурах был установлен закон, устранивший указанный недостаток. Сформулировал его в 1906 г. Нернст, и называется он третьим началом термодинамики, или теоремой Нернста.
Согласно Нернсту, изменение энтропии DS стремится к нулю при любых обратимых изотермических процессах, совершаемых между двумя равновесными состояниями при температурах, приближающихся к абсолютному нулю (ΔS -> 0 при Т -> 0).
Нернст сформулировал теорему для изолированных систем, а затем М. Планк распространил ее на случай любых систем, находящихся в термодинамическом равновесии. Как первое и второе начала термодинамики, теорема Нернста может рассматриваться как результат обобщения опытных фактов, поэтому ее часто называют третьим началом термодинамики. Иногда его формулируют следующим образом: энтропия любой равновесной системы при абсолютном нуле температуры может быть равна нулю.
Отсюда следует, что при T -> 0 интеграл  сходится на нижнем пределе, т.е. имеет конечное значение S(0) = const или S(0) = 0, причем равенство нулю рассматривается как наиболее вероятное. А нулевое значение энтропии (меры беспорядка) соответствует отсутствию теплового движения при абсолютном нуле. При T = 0 внутренняя энергия и тепловая функция системы прекращают зависеть от температуры, кроме того, используя метод термодинамических функций, можно показать, что, при T= 0, от температуры не зависит коэффициент объемного расширения, термический коэффициент давления и другие параметры системы. Согласно классическим представлениям при абсолютном нуле возможно непрерывное множество микросостояний системы.
сходится на нижнем пределе, т.е. имеет конечное значение S(0) = const или S(0) = 0, причем равенство нулю рассматривается как наиболее вероятное. А нулевое значение энтропии (меры беспорядка) соответствует отсутствию теплового движения при абсолютном нуле. При T = 0 внутренняя энергия и тепловая функция системы прекращают зависеть от температуры, кроме того, используя метод термодинамических функций, можно показать, что, при T= 0, от температуры не зависит коэффициент объемного расширения, термический коэффициент давления и другие параметры системы. Согласно классическим представлениям при абсолютном нуле возможно непрерывное множество микросостояний системы.
Объяснение теоремы Нернста можно дать только на основании квантово-механических представлений.
Третье начало термодинамики можно сформулировать следующим способом: при абсолютном нуле температуры любые изменения термодинамической системы происходят без изменения энтропии.

| т.е. | 
| или | 
|
Принцип Нернста был развит М. Планком, предположившим, что при абсолютном нуле температуры энергия системы минимальна. Тогда можно считать, что при абсолютном нуле система имеет одно квантовое состояние:
 , , 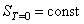 , тогда , тогда 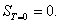
|
Значит, термодинамическая вероятность W при Т = 0 К должна быть равна единице, что недостижимо.
Следствием третьего начала является то, что невозможно охладить тело до абсолютного нуля (принцип недостижимости абсолютного нуля температуры). Иначе был бы возможен вечный двигатель II рода.
Дата добавления: 2015-01-15; просмотров: 366; Мы поможем в написании вашей работы!; Нарушение авторских прав |