
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Число степеней свободы механической системы. Поступательные, вращательные и колебательные степени свободы молекулы. Теорема о равнораспределении энергии по степеням свободы.
Число степеней свободы — это количество независимых параметров, однозначно определяющих положение механической системы.
· Простейшая механическая система — материальная точка в трёхмерном пространстве — обладает тремя степенями свободы, так как её состояние полностью описывается тремя пространственными координатами.
· Абсолютно твёрдое тело обладает шестью степенями свободы, так как для полного описания положения такого тела достаточно задать три координаты центра масс и три угла, описывающих ориентацию тела
Первоначально термин «равнораспределение» означал, что полная кинетическая энергия системы разделена одинаково среди всех её независимых частей в среднем, как только система достигла теплового равновесия. Теорема о равнораспределении также даёт количественные предсказания для этих энергий. Например, она предсказывает, что каждый атом благородного газа, находящегося в тепловом равновесии при температуре T, обладает средней кинетической энергией поступательного движения равной (3/2)kBT. Как следствие, более тяжёлые атомы ксенона обладают более низкой средней скоростью чем лёгкие атомы гелия при той же самой температуре. Закон равнораспределения показывает, что при тепловом равновесии, любая степень свободы (компоненты векторов положения или скорость частицы), которая появляется только как квадратичная функция в энергии, обладает средней энергией равной ЅkBT и поэтому вносит вклад ЅkB в теплоёмкость системы
39. Классическая теория теплоёмкости идеальных газов.
Теплоемкость идеального газа - это отношение тепла, сообщенного газу, к изменению температуры δТ, которое при этом произошло. 
Молярная теплоемкость - теплоемкость 1 моля идеального газа.


где i - число степеней свободы частиц газа.
CP=δQ/νΔT=CV+R=(1+i/2)*R
В изотермическом процессе постоянна температура, т.е. dT = 0. Следовательно, теплоемкость идеального газа стремится к бесконечности: 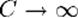
В адиабатическом процессе теплообмена с окружающей средой не происходит, т.е. δQ=0. Следовательно, теплоемкость идеального газа в адиабатическом процессе также равна нулю: Садиаб=0.
40. Классическая теория теплоёмкости твёрдых тел (кристаллов). Закон Дюлонга и Пти.
Закон Джоуля-Коппа описывает теплоёмкость сложных (т.е. состоящих из нескольких химических элементов) кристаллических тел. Основан на законе Дюлонга-Пти. Каждый атом в молекуле имеет три колебательных степени свободы, и он обладает энергией  . Соответственно, молекула из n атомов обладает в n раз большей энергией:
. Соответственно, молекула из n атомов обладает в n раз большей энергией: 
Молярная теплоёмкость вещества равна: 
то есть она в n раз больше теплоёмкости кристалла с одноатомными молекулами. Иными словами, молярная теплоёмкость вещества равна сумме теплоёмкостей составляющих его химических элементов. Важно отметить, что закон Джоуля-Коппа выполняется даже для кристаллов, содержащих в своей структуре не подчиняющиеся закону Дюлонга-Пти химические элементы.
Закон Дюлонга-Пти (Закон постоянства теплоёмкости) — эмпирический закон, согласно которому молярная теплоёмкость твёрдых тел при комнатной температуре близка к 3R:
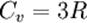
где R — универсальная газовая постоянная.
Закон выводится в предположении, что кристаллическая решетка тела состоит из атомов, каждый из которых совершает гармонические колебания в трех направлениях, определяемыми структурой решетки, причем колебания по различным направлениям абсолютно независимы друг от друга. При этом получается, что каждый атом представляет три осциллятора с энергией E, определяемой следующей формулой:
 .
.
Формула вытекает из теоремы о равнораспределении энергии по степеням свободы. Так как каждый осциллятор имеет одну степень свободы, то его средняя кинетическая энергия равна  , а так как колебания происходят гармонически, то средняя потенциальная энергия равна средней кинетической, а полная энергия - соответственно их сумме. Число осцилляторов в одном моле вещества составляет
, а так как колебания происходят гармонически, то средняя потенциальная энергия равна средней кинетической, а полная энергия - соответственно их сумме. Число осцилляторов в одном моле вещества составляет  , их суммарная энергия численно равна теплоемкости тела - отсюда и вытекает закон Дюлонга-Пти.
, их суммарная энергия численно равна теплоемкости тела - отсюда и вытекает закон Дюлонга-Пти.
Дата добавления: 2015-01-19; просмотров: 389; Мы поможем в написании вашей работы!; Нарушение авторских прав |