
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Адиабатный процесс. Процессы, протекающие без теплообмена рабочего тела с окружающей средой, называются адиабатными процессами (dq = 0 и q =0)
Процессы, протекающие без теплообмена рабочего тела с окружающей средой, называются адиабатными процессами (dq = 0 и q =0). Линия, изображающая адиабатный процесс, называется адиабатой.
Для вывода уравнения адиабатного процесса используем уравнения первого закона термодинамики (2.24) и (2.16)
cpdT -udp = 0
cudT + pdu= 0,
откуда 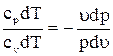 или
или 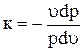 , отсюда кpdu = - udp. (a)
, отсюда кpdu = - udp. (a)
Левую и правую часть уравнения (а) разделим на pu и запишем
 . (в)
. (в)
Проинтегрировав уравнение (в), получим
к lnu+ lnp = const,
или ln puк = const.
Если логарифм какой-то величины const, то и сама величина будет const. Отсюда получаем уравнение адиабаты
puк = const. (4.16)

|
Из аналитической геометрии известно, что уравнение (4.16) является уравнением неравнобокой гиперболы (рис. 4.7). На рисунке 1-2 - расширение, 1-3 - сжатие.
На рисунке для сравнения изображена также изотерма. Т.к. к > 1, поэтому адиабата проходит всегда круче, чем изотерма. Найдем соотношения между параметрами в адиабатном процессе:
а) p = f(u). Из уравнения адиабаты
p1u1к = p2u2к. Следовательно,
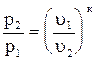 или
или 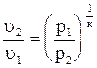 ; (4.17)
; (4.17)
б) Т = f(u). Записав уравнение состояния в виде p = RT/u, подставим его в уравнение адиабаты (4.16) и получим RТuк/u = const. Поскольку R для данного газа const, то, поделив на R последнее уравнение в его правой части, получим новую const.
Tuк-1 = const. (4.18)
Из уравнения (4.18) получим 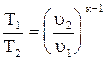 ; (4.19)
; (4.19)
в) T = f(p). Записав уравнение состояния в виде u = RT/p, подставим его в уравнение адиабаты (4.16) и получим RкTкp/pк = const. Поделив это уравнение на Rк, получим Ткр1-к = const. Извлекая корень к-й степени, получаем 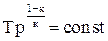 . Откуда
. Откуда 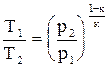 или
или  . (4.20)
. (4.20)
Изменение внутренней энергии Du = cu(T2 - T1).
Работу изменения объема найдем из уравнения первого закона термодинамики du + dl = 0, отсюда dl = - du,
или l = - (u2 - u1) - u1 - u2 = cu(T1 - T2). (4.21)
То есть работа адиабатного расширения совершается в результате изменения внутренней энергии рабочего тела, которая уменьшается на величину, эквивалентную совершенной работе. При отрицательной работе (работе сжатия) внутренняя энергия возрастает на величину затраченной работы.
Подставив в уравнение (4.21) значение сu = R/(к-1), получим
 . (4.22)
. (4.22)
Заменив в уравнении (4.22) произведения RT1 = p1u1 и RT2 = p2u2 по уравнению состояния, получим
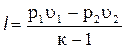 . (4.23)
. (4.23)
Уравнение (4.23) может быть представлено в следующем виде:
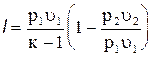 , помня, что по (4.17)
, помня, что по (4.17) 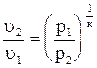
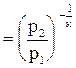 , получим
, получим
 . (4.24)
. (4.24)
Так как по уравнению (а) крdu = - udp, то следовательно
кdl = dl¢ или l¢ = кl. (4.25)
Отсюда техническая работа
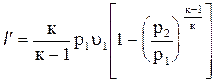 . (4.26)
. (4.26)
Если говорить о теплоемкости в адиабатном процессе, то, очевидно,
c = dq/dT =0, т.к. dq = 0.
Адиабатный процесс является изоэнтропийным процессом, т.к. для него
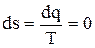 и Ds = s2 - s1 = 0. ( 4.27)
и Ds = s2 - s1 = 0. ( 4.27)

|
В координатах T, s адиабата вертикальная прямая: 1-2 - расширение, 1-3 - сжатие (рис. 4.8).
Дата добавления: 2015-01-19; просмотров: 306; Мы поможем в написании вашей работы!; Нарушение авторских прав |