
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Политропный процесс. Выведем уравнение политропного процесса
Выведем уравнение политропного процесса. Для этого введем понятие о политропной теплоемкости - с. Тогда dq = cdT. С учетом этого запишем уравнения первого закона термодинамики (2.24) и (2.16)
сdТ = cpdT -udp,
сdТ = cudT + pdu ,
откуда  . Обозначим
. Обозначим  - показатель политропы.
- показатель политропы.
Тогда последнее уравнение запишется:
npdu = - udp. (а)
Разделив уравнение (а) на pu, запишем  Проинтегрировав это уравнение, получим n ln u + ln p = const или ln pun = const.
Проинтегрировав это уравнение, получим n ln u + ln p = const или ln pun = const.
Откуда получим уравнение политропы
pun = const. (4.28)
Политропным называется такой процесс изменения состояния рабочего тела, в котором показатель политропы n остается постоянным на протяжении всего процесса.
Формулы соотношения параметров газа в политропном процессе, которые являются следствием уравнений pun = const и pu = RT, очевидно, будут иметь тот же вид, что и выведенные выше в адиабатном процессе, но только в них показатель адиабаты к нужно заменить показателем политропы n:
 ;
;  и
и  .
.
Изменение внутренней энергии Du и энтальпии Dh в политропном процессе, как и в любом термодинамическом процессе, найдется по уравнениям
Du = u2 - u1 = cu(T2 - T1) и Dh = h1 - h2 = cp(T2 - T1).
Формулы для работы изменения объема могут быть найдены по уравнению 
 , куда подставляют р = р1u1n/vn, где p и u - текущие значения параметров.
, куда подставляют р = р1u1n/vn, где p и u - текущие значения параметров.
В результате интегрирования получим
 . (4.29)
. (4.29)
Выражение (4.29), аналогичное адиабатному процессу, можно представить как
 , (4.30)
, (4.30)
и  . (4.31)
. (4.31)
Формула для технической работы согласно уравнению (а) l¢ = nl, т.е.
 . (4.32)
. (4.32)
Теплоемкость газа в политропном процессе можно найти из равенства
n = (c - cp)/(c - cu). Откуда имеем nc - ncu= c - cp или nc - c = ncu - кcu отсюда
с(n-1) = cu(n-к). Окончательно получим
 . (4.33)
. (4.33)
Теплоемкость газа в политропном процессе в зависимости от значения показателя политропы n может быть положительной, отрицательной, равной нулю или бесконечности.
Количество тепла, участвующего в процессе:
 . (4.34)
. (4.34)
Политропный процесс является обобщающим для всех ранее рассмотренных процессов. В этом нетрудно убедиться, подставляя в выражение
n = (c - cp)/(c - cu) значения соответствующих политропных теплоемкостей:
1) для изохорного процесса
с = сu;  . Уравнение pun = const представим в виде
. Уравнение pun = const представим в виде  , тогда
, тогда  .
.
Следовательно, при n = ±¥ уравнение политропы обратилось в уравнение изохоры;
2) для изобарного процесса
с = ср;  ;
;  ;
;
3) для изотермического процесса
 .
.
Следовательно, n - 1 = 0; n=1 и pun = pu = const;
4) для адиабатного процесса

|
с=0;  ; pun = puк = const.
; pun = puк = const.
Если в координатах p, u выбрать произвольную точку А (рис. 4.9) и провести из т.А все рассмотренные выше процессы, а также сколько угодно других процессов, в которых показатель политропы меняется от +¥ до - ¥, то можно по графику процесса сказать о знаках работы, теплоты и изменения внутренней энергии, а также о знаке показателя n (как это показано на
рис. 4.9). Так, например, во всех процессах, исходящих из точки А и идущих правее адиабаты теплота, будет подводиться к рабочему телу q>0, а в противоположной области отводиться q<0 и т.д.
Изменение энтропии в политропном процессе  или в интегральной форме
или в интегральной форме
 . (4.35)
. (4.35)

|
Представим основные процессы как частные случаи политропного процесса в координатах T, s (рис. 4.10). Области положительной и отрицательной работы, теплоты и изменения внутренней энергии показаны на рисунке. Показатель политропы n может быть определен, если известны параметры двух точек процесса.  , отсюда
, отсюда 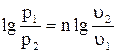 . Тогда
. Тогда  или
или  . В литературе также приводятся чисто графические способы определения показателя политропы.
. В литературе также приводятся чисто графические способы определения показателя политропы.
Дата добавления: 2015-01-19; просмотров: 1133; Мы поможем в написании вашей работы!; Нарушение авторских прав |