
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Система уравнений для выполнения термодинамического расчета
Термодинамический расчета горения выполняется в предположении отсутствия ионизации ПС. Система для расчета включает следующие уравнения:
диссоциации;
сохранения вещества;
закона Дальтона;
сохранения полной энтальпии.
Уравнения диссоциации описывают обратимые реакции диссоциации. Из химической термодинамики известно, что если в газовой смеси протекает обратимая реакция типа  , то для условий химического равновесия константа равновесия этой реакции запишется следующим образом:
, то для условий химического равновесия константа равновесия этой реакции запишется следующим образом:
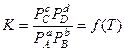 ,
,
где A, B, C, D – вещества, участвующие в данной реакции; a, b, c, d – число молей этих веществ;  – парциальные давления.
– парциальные давления.
Для идеальных газов константа К от давления не зависит, а определяется только типом реакции и температурой газа. Известно, что число независимых уравнений констант равновесия равно числу учитываемых веществ в ПС за вычетом числа элементов в топливе.
Уравнения сохранения вещества выражают равенство числа грамм-атомов каждого химического элемента в топливе и продуктах сгорания. Эти уравнения можно записать, рассмотрев условную реакцию сгорания топлива. Запишем, например, такое уравнение для четырехэлементного топлива:
 ,
,
где  – числа молей
– числа молей  , которые образуются при сгорании одного условного моля топлива. Очевидно, что число атомов произвольно выбранного элемента в левой и правой частях этого уравнения должно быть одинаково. Так, например, баланс элементов водорода
, которые образуются при сгорании одного условного моля топлива. Очевидно, что число атомов произвольно выбранного элемента в левой и правой частях этого уравнения должно быть одинаково. Так, например, баланс элементов водорода
 .
.
Количество уравнений сохранения вещества равно числу элементов в топливе. Уравнение закона Дальтона записывается в виде:
 .
.
Вместо него можно записать уравнение для общего числа молей
 ,
,
если в качестве неизвестных выбраны не парциальные давления, а числа молей  .
.
При выполнении термодинамического расчета часто рассматривают сгорание такого количества молей топлива  , которое обеспечивает равенство
, которое обеспечивает равенство  , а следовательно, и равенство
, а следовательно, и равенство  .
.
Если ввести  , то, например, уравнение сохранения для водорода будет иметь вид:
, то, например, уравнение сохранения для водорода будет иметь вид:
 .
.
Аналогично записывают балансовые уравнения и для других элементов. В них правая часть представляет количество грамм-атомов элемента в продуктах сгорания  молей топлива, а левая часть – количество грамм-атомов элемента в
молей топлива, а левая часть – количество грамм-атомов элемента в  молях топлива.
молях топлива.
Уравнение сохранения полной энтальпии для 1 кг топлива записывается на основании закона сохранения энергии  , где
, где  – полная энтальпия ПС при температуре сгорания
– полная энтальпия ПС при температуре сгорания  .
.
Если рассматривается сгорание  молей топлива, то уравнение сохранения полной энтальпии имеет вид
молей топлива, то уравнение сохранения полной энтальпии имеет вид
 ,
,
где  – полная энтальпия одного моля топлива при температуре подачи;
– полная энтальпия одного моля топлива при температуре подачи;
 – полная энтальпия i-го вещества в ПС при температуре сгорания
– полная энтальпия i-го вещества в ПС при температуре сгорания  (справочное данное).
(справочное данное).
Для расчета значения энтропии веществ при других давлениях, но при той же температуре, используется известное в термодинамике соотношение
 ,
,
где  – универсальная газовая постоянная;
– универсальная газовая постоянная;
 – физ. атм.
– физ. атм.
Энтропия ПС определяется суммированием энтропий всех составляющих веществ:
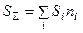 .
.
Уравнение энергии  используется в этих расчетах для определения скорости газового потока. В частности, скорость истечения из сопла
используется в этих расчетах для определения скорости газового потока. В частности, скорость истечения из сопла
 или
или  .
.
Как уже было сказано ранее, показатель изоэнтропы находят по зависимости (3).
Дата добавления: 2015-01-19; просмотров: 215; Мы поможем в написании вашей работы!; Нарушение авторских прав |