
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Рабочего тела в камере сгорания и в выходном сечении сопла
Как уже отмечалось, при сгорании четырехэлементного топлива, содержащего C, H, N и O (условная формула имеет вид 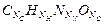 ) образуется 11 газов, составляющих в сумме более 99% массы продуктов сгорания:
) образуется 11 газов, составляющих в сумме более 99% массы продуктов сгорания:  ,
,  ,
, 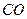 ,
,  ,
,  ,
,  ,
, 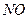 ,
,  ,
,  ,
,  ,
,  . Роль других возможных соединений, например,
. Роль других возможных соединений, например,  , ионов, электронов и др., пренебрежимо мала в диапазоне температур и давлений, свойственных жидкостным ракетным двигателям. Поскольку эти одиннадцать соединений образованы из четырех простых веществ, можно записать семь независимых реакций диссоциации и рекомбинации в форме семи констант равновесия, например, в следующем виде:
, ионов, электронов и др., пренебрежимо мала в диапазоне температур и давлений, свойственных жидкостным ракетным двигателям. Поскольку эти одиннадцать соединений образованы из четырех простых веществ, можно записать семь независимых реакций диссоциации и рекомбинации в форме семи констант равновесия, например, в следующем виде:
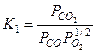 ;
;  ;
; 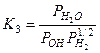 ;
;  ;
;  ;
;  ;
; 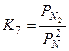 .
.
Каждая из констант равновесия зависит только от температуры. С целью упрощения расчета считают, что мольная концентрация i-го компонента 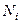 связана с его парциальным давлением соотношением
связана с его парциальным давлением соотношением  .
.
К вышеуказанным уравнениям необходимо добавить уравнения баланса элементов (с учетом  ):
):
для углерода
 ;
;
для водорода
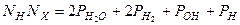 ;
;
для азота
 ;
;
для кислорода
 ,
,
где  – количество молей исходного топлива, являющееся наряду с парциальными давлениями неизвестной величиной.
– количество молей исходного топлива, являющееся наряду с парциальными давлениями неизвестной величиной.
Замыкающим является уравнение суммарного числа молей для смеси компонентов
 ,
,
или уравнение закона Дальтона
 .
.
Полученная система из двенадцати уравнений, содержащая двенадцать неизвестных, может быть решена различными способами, например, методом, описанным ниже и заключающимся в последовательном логарифмировании, линеаризации и решении системы уравнений.
Сущность указанного метода состоит в следующим. Рассмотрим, например, уравнение диссоциации углекислого газа
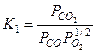 .
.
В логарифмической форме оно имеет вид
 .
.
Линеаризуя это уравнение в окрестности какого-либо начального приближения парциальных давлений 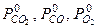 , можно в итоге записать:
, можно в итоге записать:
 ,
,
где  ;
;
 .
.
Уравнение баланса углерода после логарифмирования имеет вид
 .
.
После линеаризации в окрестностях начального приближения получим
 ,
,
где  ;
;
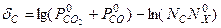 .
.
Аналогичные преобразования уравнения закона Дальтона (линеаризация в окрестностях парциальных давлений  ) приводят к уравнению
) приводят к уравнению
 ,
,
где  .
.
Здесь  – давление в камере сгорания.
– давление в камере сгорания.
Таким образом, проводя линеаризацию всех исходных уравнений, получим линейную систему алгебраических уравнений, в которой в качестве неизвестных фигурируют параметры 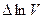 (V – парциальные давления и число молей исходного топлива).
(V – парциальные давления и число молей исходного топлива).
Расчет проводят при заданных температуре и давлении методом последовательных приближений. В качестве начальных значений искомых неизвестных можно принять одинаковые значения парциальных давлений, а начальное значение  выбрать из условия равенства масс продуктов сгорания и исходного топлива, т.е.
выбрать из условия равенства масс продуктов сгорания и исходного топлива, т.е.
 ,
,
где 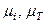 – молекулярные массы соответственно i-го компонента и исходного топлива.
– молекулярные массы соответственно i-го компонента и исходного топлива.
Затем, решая систему линейных уравнений, находят поправки к неизвестным и далее уточненные значения искомых неизвестных (их логарифмов):
 ;
;
 ,
,
которые являются начальными значениями для следующего приближения. Указанная процедура повторяется до достижения заданной точности определения неизвестных.
Расчеты по описанному алгоритму проводятся для трех-четырех ориентировочных значений температур в камере сгорания (например, 3200, 3400, 3600, 3800 К). Для каждой температуры определяют молекулярную массу  , полную энтальпию
, полную энтальпию 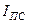 и энтропию продуктов сгорания по следующим формулам:
и энтропию продуктов сгорания по следующим формулам:
 ;
;  ;
;  ,
,
где  – справочные значения соответственно полной энтальпии и стандартной энтропии i-го компонента смеси, причем в формуле для энтропии значения давлений
– справочные значения соответственно полной энтальпии и стандартной энтропии i-го компонента смеси, причем в формуле для энтропии значения давлений  надо подставлять в физических атмосферах, а размерность
надо подставлять в физических атмосферах, а размерность  .
.
Искомую температуру  определяют по формуле линейной интерполяции на основании уравнения сохранения энергии в форме баланса энтальпий:
определяют по формуле линейной интерполяции на основании уравнения сохранения энергии в форме баланса энтальпий:
 .
.
Так же по формуле линейной интерполяции находят молекулярную массу  и энтропию
и энтропию  при полученной температуре.
при полученной температуре.
Для расчета состава и температуры продуктов сгорания в выходном сечении сопла может быть применен упрощенный метод расчета, основанный на допущении пренебрежимо малого содержания в продуктах сгорания атомарных газов и окиси азота ( при  ). В этом случае нужно учитывать содержание только
). В этом случае нужно учитывать содержание только  ,
,  ,
, 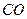 ,
,  ,
,  .
.
Исходные уравнения для расчета состава продуктов сгорания:
констант равновесия
 ;
;
баланса элементов в относительной форме
 ;
;  ;
;  ;
;
закона Дальтона
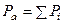 .
.
Данная система решается аналитически при трех-четырех значениях температур, лежащих в зависимости от топлива в пределах от 1200 до 2200 К. Температуру продуктов сгорания  определяют по формуле линейной интерполяции из уравнения сохранения энтропии
определяют по формуле линейной интерполяции из уравнения сохранения энтропии  в предположении об изоэнтропном расширении газа в сопле. Также находится полная энтальпия ПС на срезе сопла
в предположении об изоэнтропном расширении газа в сопле. Также находится полная энтальпия ПС на срезе сопла  и молекулярная масса
и молекулярная масса 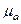 .
.
Дата добавления: 2015-01-19; просмотров: 222; Мы поможем в написании вашей работы!; Нарушение авторских прав |