
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Примеры решения задач. Пример 1. Вычислите осмотическое давление раствора, содержащего в 1,4 л 63 г глюкозы С6Н12О6 при 00С.
Пример 1. Вычислите осмотическое давление раствора, содержащего в 1,4 л
63 г глюкозы С6Н12О6 при 00С.
Д а н о: m = 63 г, V = 1,4 л, Т = 00С. Найти p.
Р е ш е н и е. Осмотическое давление раствора определяют согласно закону Вант-Гоффа: 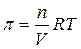 . Зная массу глюкозы, можно найти ее количество вещества n: молярная масса глюкозы равна 180,16 г/моль,
. Зная массу глюкозы, можно найти ее количество вещества n: молярная масса глюкозы равна 180,16 г/моль,  , следовательно, в 1,4 л раствора содержится 0,35 моль глюкозы. Осмотическое давление этого раствора :
, следовательно, в 1,4 л раствора содержится 0,35 моль глюкозы. Осмотическое давление этого раствора :
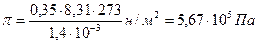
Пример 2. Определите температуру кипения и замерзания раствора, содержащего 1 г нитробензола С6Н5NO2 в 10 г бензола. Эбулиоскопическая и криоскопическая константы соответственно равны 2,57 и 5,10С. Температура кипения чистого бензола 80,20С, температура замерзания –5,40С.
Д а н о: g = 1 г, G = 10 г, Кэ = 2,570С, Кк = 5,10С, Тк бенз = 80,20С, Тз бенз = –5,40С.
Найти Тк р-ра и Тз р-ра
Р е ш е н и е 1) Из закона Рауля следует, что
 ,
, 

2) Рассчитаем молярную массу нитробензола:
Mr (C6H5NO2) = 123,11 г/моль.
3) Повышение температуры кипения раствора нитробензола в бензоле:
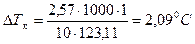
4) Температура кипения раствора: Тк = 80,2 + 2,09 = 82,290С.
5) Понижение температуры замерзания раствора нитробензола в бензоле:

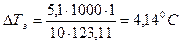
6) Температура замерзания раствора: Тз = 5,4 – 4,14 = 1,260С.
Пример 3. Раствор камфоры массой 0,552 г в 17 г эфира кипит при температуре на 0,4610С выше, чем чистый эфир. Эбулиоскопическая постоянная эфира 2,160С. Определите молекулярную массу камфоры.
Д а н о: g = 0,552 г, G = 17 г, Кэ = 2,160С. Найти Mr камфоры
Р е ш е н и е.
Молекулярную массу камфоры можно определить, пользуясь соотношением

Таким образом, молекулярная масса камфоры равна 155,14 г/моль.
Пример 4. Вычислите давление пара над раствором, содержащим 34,23 г сахара С12Н22О11, в 45,05 г воды при 650С, если давление паров воды при этой температуре равно 2,5×104 Па.
Д а н о: m(С12Н22О11) = 34,23 г, m (H2O) = 45,05 г, Р0 = 2,5×104 Па. Найти Р.
Р е ш е н и е. 1) Относительное понижение давления пара растворителя над раствором согласно закону Рауля выражается соотношением 
2) Рассчитаем молярные массы сахара и воды:
М (С12Н22О11) = 342,30 г/моль, М (Н2О) = 18,02 г/моль.
3) Найдем количество растворенного вещества и растворителя:
 ,
, 
4) Давление пара над раствором:

Дата добавления: 2015-01-29; просмотров: 858; Мы поможем в написании вашей работы!; Нарушение авторских прав |