
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Примеры решения задач. Пример 1. Определить степень окисления ванадия в молекуле Na4V2O7.
Пример 1. Определить степень окисления ванадия в молекуле Na4V2O7.
Р е ш е н и е. Суммарный заряд молекулы равен нулю. Атомы Na и O относятся к элементам с постоянной степенью окисления (табл. 3). Учитывая, что в молекуле Na4V2O7 4 атома натрия и 7 атомов кислорода, составляем уравнение:
4 (+1) + 2x + 7 (-2) =0, при решении которого находим, что степень окисления ванадия в указанном соединении равна +5: x = +5.
Пример 2. Определить степень окисления кремния в ионе SiO44–.
Р е ш е н и е. В этом случае суммарный заряд соединения равен –4. Постоянная С.О. кислорода равна –2 (табл.3). Учитывая что атомов кислорода в ионе SiO44– четыре, составляем и решаем уравнение: x+ 4 (-2) = –4, x = +4.
Пример 3. Определить, окислением или восстановлением являются данные переходы: а) H2O2 ® O2 , б) MnO4– ® MnO2.
Р е ш е н и е. а) Расставляем степени окисления элементов, входящих в состав соединений: 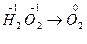 . Данный переход представляет процесс окисления, так как происходит отдача электронов ионами кислорода: 2O–1 – 2e- ® O2
. Данный переход представляет процесс окисления, так как происходит отдача электронов ионами кислорода: 2O–1 – 2e- ® O2
б) Расставляем степени окисления элементов, входящих в состав соединений:  . Данный переход представляет процесс восстановления, так как происходит присоединение электронов ионами марганца: Mn+7 + 3e– ® Mn+4.
. Данный переход представляет процесс восстановления, так как происходит присоединение электронов ионами марганца: Mn+7 + 3e– ® Mn+4.
1.12.Электрохимические процессы в гетерогенных системах.
Дата добавления: 2015-01-29; просмотров: 317; Мы поможем в написании вашей работы!; Нарушение авторских прав |