
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Вопрос 2. Классификация, получение и свойства оксидов
Вопрос 1.КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
.Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ.Сложные вещества (или химические соединения). Молекулы состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.Неорганические вещества:Простые: Металлы, НеметаллыСложные: Оксиды, Основания, Кислоты, СолиРезкой границы между металлами и неметаллами нет, т.к. есть простые вещества, проявляющие двойственные свойства.Аллотропия - способность некоторых химических элементов образовывать несколько простых веществ, различающихся по строению и свойствам.С - алмаз, графит, карбин.O - кислород, озон.S - ромбическая, моноклинная, пластическая.P - белый, красный, чёрный.Явление аллотропии вызывается двумя причинами:1) различным числом атомов в молекуле, например кислород O2 и озон O32) образованием различных кристаллических форм, например алмаз и графит.
Вопрос 2. Классификация, получение и свойства оксидов
Окси́д (о́кисел, о́кись) — бинарное соединение химического элемента с кислородом в степени окисления −2.
Химические свойства
Основные оксиды
1. Основный оксид + сильная кислота → соль + вода

2. Сильноосновный оксид + вода → гидроксид

3. Сильноосновный оксид + кислотный оксид → соль


4. Основный оксид + водород → металл + вода

Примечание: металл менее активный, чем алюминий.
Кислотные оксиды
1. Кислотный оксид + вода → кислота

Некоторые оксиды, например SiO2, с водой не вступают в реакцию, поэтому их кислоты получают косвенным путём.
2. Кислотный оксид + основный оксид → соль

3. Кислотный оксид + основание → соль + вода

Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей:


4. Нелетучий оксид + соль1 → соль2 + летучий оксид

5. Ангидрид кислоты 1 + безводная кислородосодержащая кислота 2 → Ангидрид кислоты 2 + безводная кислородосодержащая кислота 1

Амфотерные оксиды
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства:

При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
 (в водном растворе)
(в водном растворе)
 (при сплавлении)
(при сплавлении)
Получение
1. Взаимодействие простых веществ (за исключением инертных газов, золота и платины) с кислородом:


При горении в кислороде щелочных металлов (кроме лития), а также стронция и бария образуются пероксиды и надпероксиды:


2. Обжиг или горение бинарных соединений в кислороде:

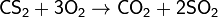

3. Термическое разложение солей:

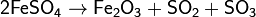
Дата добавления: 2015-01-29; просмотров: 240; Мы поможем в написании вашей работы!; Нарушение авторских прав |