
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Вопрос 3. Классификация, получение и свойства кислот
Кислотами (кислотными гидроксидами) с позиции теории электролитической диссоциации называются вещества, диссоциирующие в растворах с образованием ионов водорода.
Кислоты классифицируются по их силе, по основности и по наличию или отсутствию кислорода в составе кислоты.
По силе кислоты делятся на сильные и слабые. Важнейшие сильные кислоты – азотная HNO3, серная H2SO4, и соляная HCl.
По наличию кислорода различают кислородсодержащие кислоты (HNO3, H3PO4 и т.п.) и бескислородные кислоты (HCl, H2S, HCN и т.п.).
По основности, т.е. по числу атомов водорода в молекуле кислоты, способных замещаться атомами металла с образованием соли, кислоты подразделяются на одноосновные (например, HNO3, HCl), двухосновные (H2S, H2SO4), трехосновные (H3PO4) и т. д.
Названия бескислородных кислот производятся от названия неметалла с прибавлением окончания –водородная: HCl – хлороводородная кислота, H2Sе – селеноводородная кислота, HCN – циановодородная кислота.
Названия кислородсодержащих кислот также образуются от русского названия соответствующего элемента с добавлением слова «кислота». При этом название кислоты, в которой элемент находится в высшей степени окисления, оканчивается на «ная» или «овая», например, H2SO4 – серная кислота, HClO4 – хлорная кислота, H3AsO4 – мышьяковая кислота. С понижением степени окисления кислотообразующего элемента окончания изменяются в следующей последовательности: «оватая» (HClO3 – хлорноватая кислота), «истая» (HClO2 – хлористая кислота), «оватистая» (HОCl – хлорноватистая кислота). Если элемент образует кислоты, находясь только в двух степенях окисления, то название кислоты, отвечающее низшей степени окисления элемента, получает окончание «истая» (HNO3 – азотная кислота, HNO2 – азотистая кислота).
Получение кислот
1. Бескислородные кислоты могут быть получены при непосредственном соединении неметаллов с водородом:
H2 + Cl2 → 2HCl,
H2 + S  H2S.
H2S.
2. Кислородсодержащие кислоты нередко могут быть получены при непосредственном соединении кислотных оксидов с водой:
SO3 + H2O = H2SO4,
CO2 + H2O = H2CO3,
P2O5 + H2O = 2HPO3.
3. Как бескислородные, так и кислородсодержащие кислоты можно получить по реакциям обмена между солями и другими кислотами:
BaBr2 + H2SO4 = BaSO4 + 2HBr,
CuSO4 + H2S = H2SO4 + CuS,
CaCO3 + 2HBr = CaBr2 + CO2↑ + H2O.
4. В ряде случаев для получения кислот могут быть использованы окислительно-восстановительные реакции:H2O2 + SO2 = H2SO4,
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO↑.
Химические свойства кислот
Взаимодействие с основными оксидами с образованием соли и воды:

Взаимодействие с амфотерными оксидами с образованием соли и воды:

Взаимодействие со щелочами с образованием соли и воды (реакция нейтрализации):

Взаимодействие с нерастворимыми основаниями с образованием соли и воды, если используемая кислота растворима[32]:

Взаимодействие с солями, если выпадает осадок или выделяется газ:
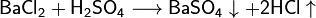
Сильные кислоты вытесняют более слабые из их солей:


(в данном случае образуется неустойчивая угольная кислота H2CO3 , которая сразу же распадается на воду и углекислый газ)
Металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (кроме азотной кислоты HNO3 любой концентрации и концентрированной серной кислоты H2SO4), если образующаяся соль растворима:

С азотной кислотой и концентрированной серной кислотами реакция идёт иначе:

Для органических кислот характерна реакция этерификации (взаимодействие со спиртами с образованием сложного эфира и воды):

Например:
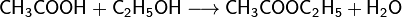
Дата добавления: 2015-01-29; просмотров: 321; Мы поможем в написании вашей работы!; Нарушение авторских прав |