
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Второй закон Рауля
Также Рауль экспериментально доказал, что
повышение температуры кипения раствора по сравнению с температурой кипения растворителя, а равно и понижение температуры замерзания раствора по сравнению с аналогичным характеризующей величиной для растворителя прямо пропорциональна моляльности раствора, то есть,
ΔTкип/зам= Kэб/кр · mв-ва, где
Kэб/кр — соответственно эбулиоскопическая (от лат. ebullire — «кипеть» и др.-греч. σκοπέω — «наблюдаю») и криоскопическая (относится к замерзанию) константы, характерные для данного растворителя;
mв-ва — моляльность вещества в растворе.
Свойства неэлектролитов:
По наличию или отсутствию электрической проводимости растворы веществ делят на электролиты – проводящие электрический ток, и неэлектролиты – не проводящие электрический ток, в силу отсутствия в них ионов.
Для описания свойств разбавленных растворов неэлектролитов используют модель идеального раствора.
Идеальным называют раствор, в котором не происходят химические реакции между компонентами, а силы межмолекулярного взаимодействия между компонентами одинаковы.
Образование этих растворов сопровождается нулевым тепловым эффектом, и каждый компонент в растворе ведет себя независимо от других компонентов. К идеальным растворам по свойствам приближаются очень разбавленные растворы неэлектролитов. К общим свойствам таких растворов относятся понижение давления насыщенного пара растворителя над раствором и температура замерзания, повышение температуры кипения и осмотическое давление.
Допустим, что из раствора при изменении температуры испаряется или кристаллизуется только растворитель, и, что растворенное вещество является неэлектролитом.
Вопрос 55. Эбулиоскопия (от лат. ebulio — вскипаю и греч. σκοπέω — смотрю) — метод исследования растворов, основанный на измерении повышения их температуры кипения по сравнению с чистым растворителем. Используется для определениямолекулярной массы растворенного вещества, активности растворителя, степени диссоциации (или изотонического коэффициента).
Температура кипения жидкости — такая температура, при которой давление пара над жидкостью равно внешнему давлению. В то же время давление пара над раствором нелетучего вещества практически полностью определяется давлением пара растворителя и, в соответствии с законом Рауля, может быть выражено уравнением:
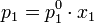
где 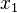 — мольная доля растворителя.
— мольная доля растворителя.
Видно, что при повышении концентрации растворенного вещества давление пара над раствором будет снижаться, а следовательно, при неизменном внешнем давлении, будет расти температура кипения.
С учетом уравнения Клапейрона — Клаузиуса можно показать[1], что изменение температуры кипения раствора (  ) может быть рассчитано по формуле:
) может быть рассчитано по формуле:
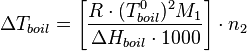
где  — энтальпия испарения;
— энтальпия испарения;
 — молярная масса растворителя;
— молярная масса растворителя;
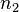 — моляльная концентрация растворенного вещества.
— моляльная концентрация растворенного вещества.
Дробь в квадратных скобках в этом выражении зависит только от свойств растворителя — это так называемаяэбулиоскопическая константа растворителя  . Она равна повышению температуры кипения одномоляльного раствора.
. Она равна повышению температуры кипения одномоляльного раствора.
Если известны изменение температуры кипения и концентрация раствора, можно определить молярную массу растворенного вещества:
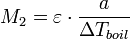
где a — число грамм растворенного вещества на 1000 г растворителя. Этот метод применим для разбавленных растворов нелетучих веществ и неэлектролитов.
Эбулиоскопический метод позволяет судить о состоянии вещества в растворах электролитов, так как для последних:
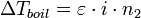 ;
;
где i — изотонический коэффициент.
С помощью эбулиоскопии можно определить и активность растворителя, в соответствии с формулой[2]:
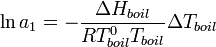
Криоскопия (от греч. κρύο — холод и греч. σκοπέω смотрю) — метод исследования растворов, в основе которого лежит измерение понижения температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя. Был предложен Ф. Раулем в 1882 году.
Криоскопия может быть использована для определения активности растворителя, в соответствии с соотношением[2]:
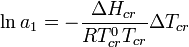
Кроме того, с помощью криоскопии можно определять степень диссоциации слабых электролитов, чистоту вещества, изучать комплексообразование в растворах и пр.
Вопрос 56. При данной температуре давление насыщенного пара над каждой жидкостью — величина постоянная. Опыт показывает, что при растворении в жидкости какого-либо вещества давление насыщенного пара этой жидкости понижается. Таким образом, давление насыщенного пара растворителя над раствором всегда ниже, чем над чистым растворителем при той же температуре. Разность между этими величинами принято называть понижением давления пара над раствором (или понижением давления пара раствора). Отношение величины этого понижения к давлению насыщенного пара над чистым растворителем называется относительным понижением давления пара над раствором.
Обозначим давление насыщенного пара растворителя над чистым растворителем через  , а над раствором через
, а над раствором через  . Тогда относительное понижение давления пара над раствором будет представлять собою дробь:
. Тогда относительное понижение давления пара над раствором будет представлять собою дробь:

Математическим выражением закона Рауля является уравнение:
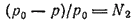
Вопрос 57. Известно, что существуют две основные причины прохождения электрического тока через проводники: либо за счет движения электронов в электрическом поле, либо за счет движения ионов. Электронная проводимость присуща, прежде всего, металлам.
Ионная проводимость присуща многим химическим соединениям, обладающим ионным строением, например солям в твердом или расплавленном состояниях, а также многим водным и неводным растворам. В связи с этим все вещества принято условно делить по их поведению в растворах на две категории: а) вещества, растворы которых обладают ионной проводимостью (электролиты); б) вещества, растворы которых не обладают ионной проводимостью (неэлектролиты). К электролитам относится большинство неорганических кислот, оснований и солей. К неэлектролитам относятся многие органические соединения, например спирты, углеводы.
Электролитическая диссоциация. Кроме хорошей электропроводности, растворы электролитов обладают более низкими значениями давления пара растворителя и температуры плавления и более высокими температурами кипения по сравнению с соответствующими значениями для чистого растворителя или для раствора неэлектролита в этом же растворителе. Для объяснения этих свойств шведский ученый С. Аррениус в 1887 г. предложил теорию электролитической диссоциации.
Под электролитической диссоциацией понимается распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов — катионов и анионов.
Коллигативные свойства – это свойства растворов, зависящие от числа частиц растворенного вещества. К коллигативным свойствам растворов относят:
1) понижение давления насыщенного пара растворителя над раствором,
2) понижение температуры замерзания и повышение температуры кипения растворов по сравнению с температурами замерзания и кипения чистых растворителей.
3) осмотическое давление.
Коллигативные свойства раствора — это свойства идеального раствора.
Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы: ,
где solut. — данный раствор, nel. solut. — раствор неэлектролита той же концентрации, Tbp — температура кипения, а Tmp — температура плавления (замерзания).
Вопрос 58. Теория электролитической диссоциации
( С. Аррениус, 1887г. )
1. При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации).
2. Под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+).
3. Электролитическая диссоциация - процесс обратимый (обратная реакция называется моляризацией).
4. Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n) к общему числу молекул, введенных в раствор (N).
Анио́н — атом, или молекула, электрический заряд которой отрицателен, что обусловлено избытком электронов по сравнению с количеством положительных элементарных зарядов. Катио́н — положительно заряженный ион.
Сольвата́ция (от лат. solvo — растворяю) — электростатическое взаимодействие между частицами (ионами, молекулами) растворенного вещества и растворителя. Сольватация в водных растворах называется гидратацией. Гидратация (от др.-греч. ὕδωρ — вода) — присоединение молекул воды к молекулам или ионам. Гидратация является частным случаем сольватации.
Вопрос 59.
Дата добавления: 2015-01-29; просмотров: 565; Мы поможем в написании вашей работы!; Нарушение авторских прав |