
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Тема 1.3 Газовые смеси
Вопросы темы
Понятия про газовые смеси. Закон Дальтона. Состав смеси в массовых и объемных долях, соотношение между ними. Состав смеси, как заданный числом молей. Густота смесей. Газовые постоянные смесей. Определение парциального давления. Кажущаяся молекулярная масса смеси.
В практике чаще всего применяются в качестве рабочего тела не однородные (чистые) газы, а механические смеси отдельных газов, например, воздух, продукты сгорания топлив и др., которые во многих случаях можно рассматривать как идеальные газы. Составляющие смеси чистых веществ называются компонентами. Давление отдельного компонента смеси Рi на стенки сосуда называется парциальным.
Согласно закону Дальтона, абсолютное давление смеси идеальных газов равно сумме парциальных давлений ее компонентов, т.е.
Рсм = Р1 + Р2 + … + Рn = ∑ Pi,
где Рсм – общее давление смеси газов;
Р1, Р2, … Рn – парциальные давления соответствующих компонентов смеси.
Таким образом, каждый компонент смеси занимает весь объем смеси Vсм и находится под своим парциальным давлением Pi. Но если этот компонент будет находится под давлением Рсм при той же температуре смеси Тсм, то он займет объем Vi, меньший объема всей смеси.
Объем данного компонента Vi, который он имел бы, если бы находился при полном давлении смеси и ее температуре, называется приведенным или парциальным.
Согласно закону Амага,
Vсм = V1 + V2 + … + Vn = ∑ Vi,
где Vсм – полный объем смеси газов;
V1, V2, … Vn – парциальные объемы компонентов, приведенные к условиям Рсм и Тсм.
Для чистых веществ достаточно знать только два какие-либо параметра состояния, чтобы полностью определить остальные. В случае смесей газов для определения любого параметра состояния требуется еще знать состав смеси, т.е. для смеси газов, в качестве независимых переменных добавляется величина, определяющая ее состав Z.
Тогда в общем виде уравнение состояния для смеси газов запишется так:
f (P, V, T, Z) = 0.
Состав смеси газов может быть задан массовыми, объемными и мольными долями.
Общая масса смеси:
mсм = m1 + m2 + …+ mn ,
где m1, m2, mn – массы компонентов смеси.
Массовой долей каждого компонента называется отношения массы данного компонента к массе всей смеси, т.е.
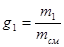 ;
;  ; ….
; ….  ;
;
и следовательно:
g1 + g2 + … + gn = ∑ gi = 1
Объемной долей компонентов называется отношение приведенного объема компонента Vi к объему всей смеси Vсм, т.е.

При этом ∑ ri = 1, т.к. ∑Vi = Vсм.
Поскольку температура компонента смеси, заполняющего весь объем смеси Vсм и при приведенном объеме Vi одинакова, то согласно уравнения PV = RT
Рi Vсм = РсмVi ;
Откуда

Из последнего соотношения получим выражение для вычисления парциального давления i-го компонента
Рi = Рсм ri .
Объемными и мольные доли численно равны. Пусть хсм – число молей смеси, а хi – число молей i-го компонента,
хсм = х1 + х2 + … + хn = ∑ хi
Соотношение  является мольной долей i-го компонента. Обозначив объем 1 кмоль любого газа при давлении и температуре смеси Vμ, получим:
является мольной долей i-го компонента. Обозначив объем 1 кмоль любого газа при давлении и температуре смеси Vμ, получим:
Vсм = Vμ хсм ; Vi = Vμхi
Тогда

Между массовыми и объемными долями существует связь, позволяющая выразить одни доли через другие. Для этого вводят понятие об условной величине – средней или кажущейся молекулярной массе смеси, т.е. о молекулярной массе такого воображаемого однородного газа, который по своим свойствам аналогичен рассматриваемой смеси.
Средней или кажущейся молекулярной массой смеси μсм называется отношение массы всей смеси mсм к общему числу ее молей хсм, т.е.

Уравнение PсмVсм = mсмRсмTсм называется уравнением состояния смеси идеальных газов.
Величина Rсм называется газовой постоянной для 1 кг смеси Rсм=∑giRi

----------------------------------------------------------------------------------------------------
Молярным объемом Vμ называется физическая величина, равная отношению объема V газа к числу N молей, содержащихся в газе Vμ = V/N. Масса молей численно равна μ. Поэтому Vμ =μV , где V – удельный объем.
Из определения моля следует, что массы молекул относятся как соответствующие молекулярные веса, моли всех веществ содержат одно и то же число молекул, равное  ,
,
где mед – масса одной молекулы, число NА – называется числом Авогадро.
Опытным путем установлено, что NА = 6,023 . 1023 моль –1.
Закон Авогадро – моли всех идеальных газов при одинаковых давлениях и температурах занимают одинаковые объемы. При нормальных условиях (Т = 273,15 0К, Р = 1,0132 . 105 Па = 1 атм = 760 мм.рт.ст.) моль любого газа имеет объем 22,415 . 10-3 м3.
Дата добавления: 2015-01-29; просмотров: 1896; Мы поможем в написании вашей работы!; Нарушение авторских прав |