
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Энтальпия и энтропия рабочего тела
Важную роль в термодинамике играет калорический параметр, представляющий собой сумму внутренней энергии и произведения PV
i = u + PV кДж/кг
и называется энтальпией.
Величина PV носит название потенциальной энергии давления и представляет работу, которую нужно затратить, чтобы ввести тело объемом V в среду с давление Р. Таким образом, если рабочее тело находится во внешней среде с давлением Р, то с любым состоянием его связана энергия u + PV, численно равная энтальпии i рабочего тела в данном состоянии.
Энтальпия идеального газа, как и внутренняя энергия, является функцией только температуры, i = f (T).
Особое значение энтальпия приобретает при рассмотрении термодинамики потока газа или пара (истечение, дросселирование), где она приобретает смысл внутренней потенциальной энергии потока.
Кроме калорических параметров i и u в термодинамике широко используется еще один калорический параметр состояния – энтропия S
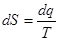
т.е. энтропия представляет собой такой параметр состояния, дифференциал которого равен отношению бесконечно малого количества теплоты в элементарно обратимом процессе к абсолютной температуре тела, которая на бесконечно малом участке процесса является постоянной величиной.
Энтропия S, как и внутренняя энергия, обладает свойством ардитивности, т.е. алгебраическая сумма изменений энтропии отдельных тел, входящих в термодинамическую систему, равна изменению энтропии термодинамической системы в целом. Интегрируя выражение для dS, получаем

С – константа интегрирования.
Следовательно, для данного состояния энтропия определяется с точностью до константы интегрирования, которая не может быть определена методами термодинамики.
Дата добавления: 2015-01-29; просмотров: 535; Мы поможем в написании вашей работы!; Нарушение авторских прав |