
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Стационарное уравнение Шредингера, его смысл.
В развитие идеи де Бройля о волновых свойствах частиц Шредингер в 1926 г. получил уравнение
104.  (20)
(20)
где m - масса частицы,  - мнимая единица, U - потенциальная энергия частицы, D - оператор Лапласа [ см. (1.10)].
- мнимая единица, U - потенциальная энергия частицы, D - оператор Лапласа [ см. (1.10)].
Решение уравнения Шредингера позволяет найти волновую функцию Y(x, y, z, t) частицы, которая описывает микросостояние частицы и ее волновые свойства.
Если поле внешних сил постоянно во времени (т.е. стационарно), то U не зависит явно от t. В этом случае решение уравнения (20) распадается на два множителя
Y(x, y, z, t) =y(x, y, z) exp[-i(E/  )t] (21)
)t] (21)
где E/  =w.
=w.
В стационарном случае уравнение Шредингера имеет вид
 (22)
(22)
где Е, U - полная и потенциальная энергия, m - масса частицы.
Следует заметить, что исторически название "волновой функции" возникло в связи с тем, что уравнение (20) или (22), определяющее эту функцию, относится к виду волновых уравнений.
104. Атом водорода и водородоподобные «атомы» (He+ , Li2+ и др.) как простейшие квантовомеханические системы: квантовые состояния, радиальная и угловая составляющие волновой функции, симметрия орбиталей.
На основании своих исследований Резерфорд в 1911 г. предложил ядерную (планетарную)модель атома. Согласно этой модели вокруг положительного ядра по замкнутым орбитам движутся электроны, образуя электронную оболочку атома, в области с линейными размерами порядка 10-10 м. Заряд ядра равен Zе (Z. -—порядковый номер элемента в системе Менделеева, е —.элементарный заряд), размер 10-15 – 10-14 м, масса, практически равна массе атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т. е. вокруг ядра должно вращаться Zэлектронов.
Атом водорода и водородоподобные системы – это системы, состоящие из ядра с зарядом Ze и одного электрона (например, ионы He+, Li2+).
Решение задачи об энергетических уровнях электрона для атома водорода (а также водородоподобных систем: иона гелия Не+, двукратно ионизованного лития Li+ + и др.) сводится к задаче о движении электрона в кулоновском поле ядра.
Потенциальная энергия взаимодействия электрона с ядром, обладающим зарядом Zе (для атома водорода Z=1),
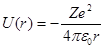
где r – расстояние между электроном и ядром. Графически функция U (r)изображена жирной кривой на рис. 6, неограниченно убывающей (возрастающей .по модулю) при уменьшении r, т. е. при приближении электрона к ядру.
Состояние электрона в атоме водорода описывается волновой функцией Ψ, удовлетворяющей стационарному уравнению Шредингера, учитывающему значение (1):'
 , (2)
, (2)
где m – масса электрона, Е – полная энергия электрона в атоме.
Это так называемое стационарное уравнение Шрёдингера для электрона водородоподобного атома ВДПА.
1. Энергия.В теории дифференциальных уравнений доказывается, что уравнения типа (2) имеют решения, удовлетворяющие требованиям однозначности, конечности и непрерывности волновой функции Ψ, только при собственных значениях энергии
 (n = 1, 2, 3,…), (3)
(n = 1, 2, 3,…), (3)
т. е. для дискретною набора отрицательных значений энергии.
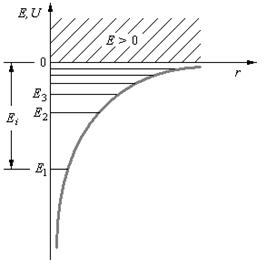
Таким образом, как и в случае «потенциальной ямы» с бесконечно высокими «стенками» , решение уравнения Шредингера для атома водорода приводит к появлению дискретных энергетических уровней. Возможные значения Е1, Е2, Е3, ... показаны па рис. 6 в виде горизонтальных прямых. Самый нижний уровень Е1, отвечающий минимальной возможной энергии, – основной,все остальные (Еn>E1, n = 2, 3,…) – возбужденные. При Е < 0 движение электрона является связаннымон находится внутри гиперболической «потенциальной ямы». Из рисунка следует, что по мере роста главного квантового числа п энергетические уровни располагаются теснее и при п=∞ Е∞= 0. При Е > 0 движение электрона является свободным;область непрерывного спектра Е >0 (заштрихована на рис. 6) соответствует ионизованному атому.Энергия ионизации атома водорода равна
Ei = - E1 = me4 / (8h2ε02) = 13,55 эВ.
2. Квантовые числа.В квантовой механике доказывается, что уравнению Шредингера (2) удовлетворяют собственные функции 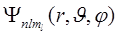 , определяемые тремя квантовыми числами: главным п, орбитальным l и магнитным ml.
, определяемые тремя квантовыми числами: главным п, орбитальным l и магнитным ml.
Главное квантовое число n,согласно (3), определяет энергетические уровни электрона в атоме и может принимать любые целочисленные значения, начиная с единицы:
n =1, 2. 3, ....
Дата добавления: 2015-01-29; просмотров: 518; Мы поможем в написании вашей работы!; Нарушение авторских прав |