
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Многоэлектронные атомы
В атоме водорода электрон находится в силовом поле, которое создается только ядром. В многоэлектронных атомах на каждый электрон действует не только ядро, но и все остальные электроны. При этом электронные облака отдельных электронов как бы сливаются в одно общее многоэлектронное облако. Точное решение уравнения Шредингера для таких сложных систем связано с большими затруднениями и, как правило, недостижимо. Поэтому состояние электронов в сложных атомах и в молекулах определяют путем приближенного решения уравнения Шредингера.
Общим для всех приближенных методов решения этого уравнения является так называемое одноэлектронное приближение, т.е. предположение, что волновая функция многоэлектронной системы может быть представлена в виде суммы волновых функций отдельных электронов. Тогда уравнение Шредингера может решаться отдельно для каждого находящегося в атоме электрона, состояние которого, как и в атоме водорода, будет определяться значениями квантовых чисел n, l, m и s. Однако и при этом упрощении решение уравнения Шредингера для многоэлектронных атомов и молекул представляет весьма сложную задачу и требует большого объема трудоемких вычислений. В последние годы подобные вычисления выполняются, как правило, с помощью быстродействующих электронных вычислительных машин, что позволило произвести необходимые расчеты для атомов всех элементов и для многих молекул.
Исследование спектров многоэлектронных атомов показало, что здесь энергетическое состояние электронов зависит не только от главного квантового числа n, но и от орбитального квантового числа l. Это связано с тем, что электрон в атоме не только притягивается ядром, но и испытывает отталкивание со стороны электронов, расположенных между данным электроном и ядром. Внутренние электронные слои как бы образуют своеобразный экран, ослабляющий притяжение электрона к ядру, или, как принято говорить, экранируют внешний электрон от ядерного заряда. При этом для электронов, различающихся значением орбитального квантового числа l, экранирование оказывается неодинаковым.
Так, в атоме натрия (порядковый номер Z=11) ближайшие к ядру К- шли L-слои заняты десятью электронами; одиннадцатый электрон принадлежит к M-слою (n = 3). На рис. 1 кривая 1 изображает радиальное распределение вероятности для суммарного электронного облака десяти «внутренних» электронов атома натрия: ближайший к ядру максимум электронной плотности соответствует К-слою, второй максимум- L-слою. Преобладающая часть внешнего электронного облака атома натрия расположена вне области, занятой внутренними электронами, и потому сильно экранируется. Однако часть этого электронного облака проникает в пространство, занятое внутренними электронами, и потому экранируется слабее.

Рисунок 1 - График радиального распределения в атоме натрия: 1 – для десяти электронов K и L-слоев; 2 – для 3S-электрона; 3 – для 3Р-электрона
Какое же из возможных состояний внешнего электрона атома натрия - 3s, Зр или 3d- отвечает более слабому экранированию и, следовательно, более сильному притяжению к ядру и более низ-кон энергии электрона? Как показывает рис. 2, электронное облако Зs-электрона в большей степени проникает в область, занятую электронами K- и L-слоев, и потому экранируется слабее, чем электронное облако Зр-электрона. Следовательно, электрон в состоянии 3s будет сильнее притягиваться к ядру и обладать меньшей энергией, чем электрон в состоянии Зр. Электронное облако Зd-орбитали практически полностью находится вне области, занятой внутренними электронами, экранируется в наибольшей степени и наиболее слабо притягивается к ядру. Именно поэтому устойчивое состояние атома натрия соответствует размещению внешнего электрона на орбитали 3s.
Таким образом, в многоэлектронных атомах энергия электрона зависит не только от главного, но и от орбитального квантового числа. Главное квантовое число определяет здесь лишь некоторую энергетическую зону, в пределах которой точное значение энергии электрона определяется величиной l. В результате возрастание энергии по энергетическим подуровням происходит примерно в следующем порядке.
В многоэлектронных атомах вследствие взаимного электростатического отталкивания электронов существенно уменьшается прочность их связи с ядром. Например, энергия отрыва электрона от иона Не+ равна 54,4 эВ, в нейтральном атоме Не она значительно меньше - 24,6 эВ. Для более тяжелых атомов связь внешних электронов с ядром еще слабее.
Важную роль в многоэлектронных атомах играет специфическое обменное взаимодействие, связанное с неразличимостью электронов, и тот факт, что электроны подчиняются Паули принципу, согласно которому, в каждом квантовом состоянии, характеризуемом четырьмя квантовыми числами, не может находиться более одного электрона. Для многоэлектронного атома имеет смысл говорить только о квантовых состояниях всего атома в целом.
Однако приближенно, в так называемом одноэлектронном приближении, можно рассматривать квантовые состояния отдельных электронов и характеризовать каждое одноэлектронное состояние (определенную орбиталъ, описываемую соответствующей функцией) совокупностью четырех квантовых чисел n, l, ml и ms. Совокупность 2(2l+ 1) электронов в состоянии с данными n и l образует электронную оболочку (называемую также подуровнем, подоболочкой); если все эти состояния заняты электронами, оболочка называется заполненной (замкнутой).
106 Эффективный заряд ядра, электронные конфигурации атомов и ионов.
В зависимости от преследуемой цели практикуются различные способы записи электронных конфигураций атомов и ионов.
Электронные оболочки. Наиболее простой способ – запись по электронным оболочкам. При этом указываются заряд ядра и количество электронов на каждый электронной оболочке по мере увеличения её номера. Например, для атома азота и его иона N+ электронная конфигурация по оболочкам выглядит так
\ \ \ \
7N (7ē) 2 5 7N+ (6ē) 2 4
/ / / /
Как было показано ранее, максимальное число электронов по n электронной оболочке равно 2n2. Тогда на первой оболочке может разместиться максимум два электрона, а на второй не более 8. Однако, у атома азота всего семь электронов (общее число электронов в атоме равно заряду ядра), поэтому на второй оболочке разместятся остальные 7 – 2 = 5 электронов. В положительно заряженном ионе азота заряд ядра превышает суммарный заряд электронов на +1, поэтому число электронов в данном ионе на один меньше, чем в атоме. При этом удаляют электрон с внешней электронной оболочки.
Электронные оболочки и подоболочки. Этот метод записи электронных конфигураций используют наиболее часто. Номер электронной оболочки (главное квантовое число) указывают цифрой, а тип подоболочки (орбитальное квантовое число) – буквой s-, p-, d- или f-. Количество электронов указывается цифрой справа вверху у символа подоболочки. Для атома и иона азота данная запись имеет следующий вид:
7N 1s22s22p3 7N+ 1s22s22p2.
В соответствии с максимальной возможной заселенностью s-подоболочек, равной 2, первые четыре электрона полностью заполняют первую и вторую подоболочки. Оставшиеся электроны размещаются на р-подоболочке.
Электронные оболочки, подоболочки и заселенность орбиталей. При обсуждении валентности атомов и ионов, изучении природы химической связи, исследовании магнитных и других свойств атомов, молекул или их ионов применяют способ записи по электронным оболочкам, подоболочкам с указанием заселенности орбиталей электронами. Опираясь на запись электронных конфигураций по оболочкам и подоболочкам, в данном способе учитывают максимальное количество атомных орбиталей (АО) электронной подоболочки и производят размещение электронов среди них в соответствии с правилом Фридриха Хунда (Гунда) (1896-1989): электроны в атоме размещаются таким образом, чтобы занять возможно большее число атомных орбиталей, чтобы абсолютное значение суммарного спина было максимальным.
Три электрона на р-подуровне можно разместить по разному

или
-↑- -↑- -↑- -↑- -↓- -↑- -↑↓- -↑- ---
Однако верным будет первый способ размещения, отвечающий правилу Хунда.
Существует другая форма записи графических электронных формул в виде ячеек.
Каждая такая ячейка обозначается: клетка – орбиталь, стрелка – электрон, направление стрелки – направление спина, свободная клетка – свободная орбиталь, которую может занимать электрон при возбуждении.
Согласно принципу Паули, в ячейке может быть один или два электрона (если два электрона, то они спарены). В таком случае, например, схема распределения электронов по квантовым ячейкам в атоме углерода следующая:
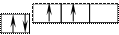
n =2 px py pz
6C 1s22s22px12py1
 n = 1
n = 1
Орбитали р-подуровня заполняются так: сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами. Поскольку на 2р-подуровне три орбитали с одинаковой энергией, то каждый из двух 2р-электро-нов занимает по одной орбитали (например, рх и ру). Одна орбиталь остается свободной (рz). Таким образом, у атома углерода два неспаренных электрона. Справа от схемы в электронной формуле дана более подробная запись с указанием расположения электронов на рх и ру-орбиталях.
В атоме азота все три 2р-орбитали заняты электронами
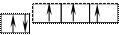
n =2 px py pz
7N 1s22s22px12py12pz1
 n = 1
n = 1
s
Согласно принципу наименьшей энергии во многих случаях электрону энергетически выгоднее занять подуровень «вышележащего» уровня, хотя подуровень «нижележащего» уровня не заполнен. Именно поэтому у элементов четвертого периода периодической системы элементов Д.И. Менделеева, сначала заполняется подуровень 4s- и лишь после этого подуровень 3d-. Элементы, у которых идет заполнение d- и f-подуровней, обычно называют переходными.
Принцип Паули.
В 1925 г. Паули установил квантово - механический принцип (принцип запрета Паули).
В любом атоме не может быть двух электронов, находящихся в одинаковых стационарных состояниях, определяемых набором четырех квантовых чисел: n, , m, ms.
Например, на энергетическом уровне может находиться не более двух электронов, но с противоположным направлением спинов.
Принцип Паули дал возможность теоретически обосновать периодическую систему элементов Менделеева, создать квантовые статистики, современную теорию твердых тел и др.
Дата добавления: 2015-01-29; просмотров: 406; Мы поможем в написании вашей работы!; Нарушение авторских прав |