
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ПЗ и строение атома.
Дальнейшие открытия в науке позволили уточнить формулировку ПЗ.
1) Было открыто сложное строение атома:

2) Были открыты изотопы – разновидности атомов одного и того же химического элемента с одинаковым числом протонов и разным массовым числом.
Например:
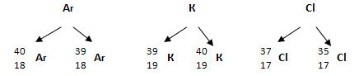
Благодаря этим открытиямсовременная формулировка ПЗ такова: Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от зарядов их атомных ядер.
3. Периодическая система (ПС)– графическое отображение ПС, поэтому принятая в ней символика соответствует особенностям строения атомов химических элементов.
1) Порядковый номер элементасоответствует заряду ядра, т.е. числу Р+ - протонов в нём. Число других частиц ядра n0 находят по формуле: n0 = A – P+. Число е- в электронной оболочке также соответствует N элемента.
2) Номер периода элементасоответствует числу слоёв или уровней для электронной оболочки атома.
3) Номер А группысоответствует числу электронов на внешнем уровне.
4) Причины изменения свойств элементовобъясняются особенностями строения их атомов.
В периодах слева направо - металлические свойства ослабевают, а неметаллические свойства усиливаются, потому что:
а) увеличиваются заряды атомных ядер
б) увеличивается число е на внешнем уровне
в) число энергических уровней постоянно
г) радиус атома уменьшается
5) В А группе сверху вниз металлические свойства усиливаются, а не металлические свойства ослабевают, потому что:
а) увеличиваются заряды атомных ядер
б) число е на внешнем уровне постоянно
в) увеличивается число энергетических уровней
г) увеличивается радиус атома
Заряд ядра атомов химических элементов возрастает монотонно, а свойства изменяются периодически, потому что свойства химических элементов находятся в периодической зависимости от зарядов ядер.
Периодический закон и периодическая система химических элементов Д. И. Менделеева на основе представлений о строении атома. 1. формулировка периодического закона Д. И. Менделеева в свете теории строения атома. Открытие периодического закона и разработка периодической системы химических элементов Д. И. Менделеевым явились вершиной развития химии в
XIX веке. Обширная сумма знаний о свойствах 63 элементов, известных к тому времени, была приведена в стройный порядок. Д. И. Менделеев считал, что основной характеристикой элементов являются их атомные веса, и в 1869 г. впервые сформулировал периодический закон. Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов. Весь ряд элементов, расположенных в порядке возрастания атомных
Дата добавления: 2015-01-29; просмотров: 845; Мы поможем в написании вашей работы!; Нарушение авторских прав |