
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Электронные семейства элементов
В зависимости от того, какой подуровень последним заполняется электронами, все элементы делятся на четыре типа – электронные семейства:
1. s – элементы; заполняется электронами s – подуровень внешнего уровня. К ним относятся первые два элемента каждого периода. Валентными1 являются электроны внешнего уровня.
2. p – элементы; заполняется электронами р – подуровень внешнего уровня. Это последние шесть элементов каждого периода (кроме I и VII). Валентными являются s- и p- электроны внешнего уровня.
3. d – элементы; заполняется электронами d – подуровень второго снаружи уровня, а на внешнем уровне – один или два электрона (y 46Pd – нуль). К ним относятся элементы вставных декад больших периодов, расположенных между s – и p – элементами (их также называют переходными элементами). Валентными являются s – электроны внешнего уровня и d – электроны предвнешнего уровня (второго снаружи).
4. f – элементы; заполняется электронами f – подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Они расположены в 6 – м (4f – элементы) и 7 – м (5f – элементы) периодах периодической системы. 4f – элементы объединяют в семейство лантаноидов, а 5f – элементы – семейство актиноидов.
В периодической системе s – элементов 14, p – элементов 30, d – элементов 38, f – элементов 28.
Атомы элементов с одинаковым заполнением внешнего энергетического уровня носят название электронных аналогов. Например:
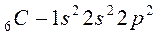 ;
;
 .
.
Элементы с одинаковым строением внешнего и предвнешнего энергетических уровней называют полными электронными аналогами. Например:
 ;
;
 .
.
116 Вертикальное, горизонтальное и диагональное сходство элементов в периодической системе.
Диагональная периодичность
Диагональная периодичность - повторяемость свойств простых веществ и соединений по диагоналям Периодической системы. Она связана с возрастание неметаллических свойств в периодах слева направо и в группах снизу вверх. Поэтому литий похож на магний, бериллий на алюминий, бор на кремний, углерод на фосфор. Так, литий и магний образуют много алкильных и арильных соединений, которые часто используют в органической химии. Бериллий и алюминий имеют сходные значения окислительно-восстановительных потенциалов. Бор и кремний образуют летучие, весьма реакционноспособные молекулярные гидриды.
Диагональную периодичность не следует понимать как абсолютное сходства атомных, молекулярных, термодинамических и других свойств. Та, в своих соединениях атом лития имеет степень окисления (+I), а атом магния - (+II). Однако свойства ионов Li+ и Mg2+ очень близки, проявляясь, в частности, в малой растворимости карбонатов и ортофосфатов.
В результате объединения вертикальной, горизонтальной и диагональной периодичности появляется так называемая звездная периодичность. Так, свойства германия напоминают свойства окружающих его галлия, кремния, мышьяка и олова. На основании таких "геохимических звезд" можно предсказать присутствие элемента в минералах и рудах.
Горизонтальная аналогия
Некоторые элементы, относящиеся к одному периоду, и, не являющиеся ни типовыми, ни электронными аналогами, тем не менее, обнаруживают значительное сходство друг с другом. Горизонтальная аналогия наблюдается у d- и f-элементов с более чем наполовину заполненными электронными подуровнями. Примером горизонтальных аналогов могут служить железо, кобальт и никель, которые при различных электронных конфигурациях ([Ar]183d64s2, [Ar]183d74s2 и [Ar]183d84s2) обладают определенным сходством.
Существование горизонтальной аналогии объясняется тем, что в рядах d- и f-элементов изменение свойств с увеличением заряда ядра замедляется (вспомним хотя бы то, что все d- и f-элементы являются металлами). Особенно медленно изменяются свойства во второй половине рядов, где в квантовых ячейках подуровней происходит образование электронных пар. С другой стороны, горизонтальными аналогами обычно являются элементы, не реализующие свою высшую степень окисления, отвечающую числу валентных электронов. Так, для железа число валентных электронов равно восьми, для кобальта - девяти, для никеля - десяти. Однако для всех этих элементов наиболее характерны степени окисления +2 и +3; железо может проявлять степень окисления +6, а кобальт и никель - +4: но подобные соединения относительно редки и обычно неустойчивы. В результате для железа, кобальта и никеля формулы основных классов соединений однотипны (например, МеО, Ме2О3, Ме(ОН)2, Ме(ОН)3 и т.д.), а свойства этих соединений, равно как и простых веществ, близки.
Аналогичное явление наблюдается и для платиновых металлов. Триады рутений, родий, палладий и осмий, иридий, платина являются горизонтальными аналогами. В то же время пары рутений-осмий, родий-иридий, палладий-платина относятся к шринк-аналогам. В результате все платиновые металлы близки по свойствам.
В ряду лантаноидов элементы подсемейства церия (Ce-Gd) сильнее отличаются друг от друга по свойствам, чем элементы подсемейства тербия (Tb-Lu); это явление также связано с горизонтальной аналогией.
Дата добавления: 2015-01-29; просмотров: 826; Мы поможем в написании вашей работы!; Нарушение авторских прав |