
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Двухцентровые молекулярные орбитали
В методе молекулярных орбиталей для описания распределения электронной плотности в молекуле используется представление о молекулярной орбитали (подобно атомной орбитали для атома). Молекулярные орбитали - волновые функции электрона в молекуле или другой многоатомной химической частице. Каждая молекулярная орбиталь (МО), как и атомная орбиталь (АО), может быть занята одним или двумя электронами. Состояние электрона в области связывания описывает связывающая молекулярная орбиталь, в области разрыхления - разрыхляющая молекулярная орбиталь. Распределение электронов по молекулярным орбиталям происходит по тем же правилам, что и распределение электронов по атомным орбиталям в изолированном атоме. Молекулярные орбитали образуются при определенных комбинациях атомных орбиталей. Их число, энергию и форму можно вывести исходя из числа, энергии и формы орбителей атомов, составляющих молекулу.
В общем случае, волновые функции, отвечающие молекулярным орбиталям в двухатомной молекуле, представляют как сумму и разность волновых функций атомных орбитале, умноженных на некоторые постоянные коэффициенты, учитывающие долю атомных орбиталей каждого атома в образовании молекулярных орбиталей (они зависят от электроотрицательности атомов):
φ(АВ) = с1ψ(А) ± с2ψ(В)
Этот метод вычисления одноэлектронной волновой функции называют "молекулярные орбитали в приближении линейной комбинации атомных орбиталей" (МО ЛКАО).
128. Ионная связь
Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностью (>1,5 по шкале Полинга) электроотрицательностей, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью. Это притяжение ионов как разноимённо заряженных тел. Примером может служить соединение CsF, в котором «степень ионности» составляет 97 %. Ионная связь — крайний случай поляризацииковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу, образуются ионы.
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ЭО > 1,7 по Полингу), то общаяэлектронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов:
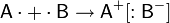
129. Ионные молекулы и ионные кристаллы.
Ионная связь. Ионные кристаллы
Химическая связь может возникнуть при электростатическом притяжении двух разноименных ионов - катиона и аниона, например, K+ и I−. Перекрывание атомных орбиталей в этом случае незначительно, и электронная плотность распределена неравномерно, недостаток её будет у атома калия, а избыток - у атома иода.
Ионную связь (K+)−(I−) рассматривают как предельный случай ковалентной связи.
Общая пара электронов в случае ионной связи практически полностью смещена к аниону. Обычно это происходит в соединениях элементов с большой разностью электроотрицательности (например, в соединениях CsF, NaBr, K2O, Rb2S, Li3N и др.).
Все эти соединения при обычных условиях представляют собой ионные кристаллы (кристаллы, построенные из катионов и анионов), например кристаллы иодида калия или хлорида натрия.
Металлическая связь. Металлические кристаллы
В металлах валентные электроны удерживаются атомами крайне слабо и способны мигрировать. Атомы, оставшиеся без внешних электронов, приобретают положительный заряд. Они образуют металлическую кристаллическую решётку.
Совокупность обобществлённых валентных электронов (электронный газ), заряженных отрицательно, удерживает положительные ионы металла в определённых точках пространства - узлах кристаллической решётки, например, металла серебро.
Внешние электроны могут свободно и хаотично перемещаться, поэтому металлы характеризуются высокой электропроводностью (особенно золото, серебро, медь, алюминий).
Атомные и молекулярные кристаллы
В твердом агрегатном состоянии у веществ могут образоваться не только ионные, но также молекулярные и атомные кристаллические решетки.
Так, твердый иод имеют молекулярную кристаллическую решетку, в узлах которых находятся молекулы I2.
Аналогичным образом построена кристаллическая решетка твердого диоксида углерода (сухой лед) - в узлах кристаллической решетки находятся молекулы CO2.
Алмаз и графит - кристаллы с атомной решеткой, имеющей в узлах атомы углерода с разным расположением этих узлов в пространстве.
Водородная связь
При изучении многих веществ были обнаружены так называемые водородные связи.
Например, молекулы HF в жидком фтороводороде связаны между собой водородной связью, аналогично связаны молекулы Н2О в жидкой воде или в кристалле льда, а также молекулы NH3 и Н2О между собой в межмолекулярном соединении - гидрате аммиака NH3 · Н2О.
Водородная связь образуется за счёт сил электростатического притяжения водородсодержащих полярных молекул, содержащих атомы наиболее электроотрицательных элементов - F, O, N. Например, водородные связи имеются в HF, Н2О, NH3, но их нет в HCl, Н2S, PH3.
Водородные связи малоустойчивы и разрушаются довольно легко (например при плавлении льда, кипении воды). Однако на разрыв этих связей затрачивается некоторая дополнительная энергия, и поэтому температуры плавления и кипения веществ с водородными связями между молекулами оказываются значительно выше, чем у подобных веществ, но без водородных связей:
Дата добавления: 2015-01-29; просмотров: 329; Мы поможем в написании вашей работы!; Нарушение авторских прав |