
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Частина.
2.1
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑;
2Na+ + C  + 2H+ + 2Сl– = 2Na+ + 2Сl– + H2O + CO2↑;
+ 2H+ + 2Сl– = 2Na+ + 2Сl– + H2O + CO2↑;
2H+ + C  = H2O + CO2↑.
= H2O + CO2↑.
2.2
 Дано: Розв’язання
Дано: Розв’язання
m(K2SO4) = 43,5 г.
 N(K+ + S
N(K+ + S  ) – ? 1. Знаходимо кількість речовини калій сульфату:
) – ? 1. Знаходимо кількість речовини калій сульфату:
v(K2SO4) = m(K2SO4) : M(K2SO4) = 43,5 г : 174 г/моль = 0,25 моль.
2.Визначаємо кількість формульних одиниць калій сульфату: N(K2SO4) =
= v(K2SO4)·NA = 0,25 моль · 6,02 · 1023 форм, од./моль = 1,505 · 1023 форм. од.
3.Електролітична дисоціація калій сульфату відбувається за рівнянням:
K2SO4 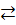 2К+ + S
2К+ + S 
Як видно з рівняння, під час електролітичної дисоціації однієї формульної одиниці калій сульфату утворюються 3 йони (2 йони Калію й один сульфат-іон), тому загальна кількість йонів становить:
N(K+ + 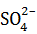 ) = 3 · N(K2SO4) = 3 · 1,505 · 1023 форм. од. = 4,515·1023 йонів.
) = 3 · N(K2SO4) = 3 · 1,505 · 1023 форм. од. = 4,515·1023 йонів.
Відповідь: N(K+ + S  ) = 4,515 · 1023 йонів.
) = 4,515 · 1023 йонів.
2.3
 Дано: Розв’язання
Дано: Розв’язання
 N(NH3) – 1,204 • 10 молекул. 1. Знаходимо кількість речовини амоніаку: m(NH3) –? v(NH3) = N(NH3): NA =
N(NH3) – 1,204 • 10 молекул. 1. Знаходимо кількість речовини амоніаку: m(NH3) –? v(NH3) = N(NH3): NA =
= 1,204 • 1023 молекул : 6,02 • 1023 молекул/моль = 0,2 моль.
2. Обчислюємо масу амоніаку:
M(NH3) =17 г/моль;
т(NH3) = v(NH3) • M(NH3) = 0,2 моль • 17 г/моль = 3,4 г.
Відповідь: m(NH3) = 3,4 г.
2.4
Дата добавления: 2015-04-21; просмотров: 283; Мы поможем в написании вашей работы!; Нарушение авторских прав |