
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Вопрос 1
Белки – полимеры 22 природных АК со специфической структурой.
Выделяют 4 уровня пространственной организации:
Первичная структура – последовательность АК-ных остатков в полипептидной цепи, образуется за счет пептидных связей, возникающих за счет альфа-карбоксильной группы одной АК и альфа-аминогруппы последующей АК.
Вторичная структура – способ укладки полипептидной цепи в альфа-спираль или β-структуру за счет менее прочных водородных связей (Нᵟ⁺ . . . Оᵟ⁻).
Третичная структура – пространственная укладка α-спирали или полипептидной цепи в определенную конформацию за счет 4-х видов связей:
1. Водородных: Нᵟ⁺ . . . Оᵟ⁻,
2. Ионных (соленообразующих): -NH₃+ . . . C ⸗ˎᵒₒ₋
3. Дисульфидных : - S – S –
4. Гидрофобных (сил Вандер-Ваальса).
Третичная структура – субъединица.
Четвертичная структура – «комплекс субъединиц, способных к диссоциации» (Джон Бернал), или объединение в определенном порядке 2-х и большего количества субъединиц в молекуле олигомерного белка.
Например, молекула гемоглобина состоит из 4-х субъединиц (по 17000 Д каждая).


Вопрос 29
Многие белки имеют в своем составе несколько полипептидных цепей. Такие белки называют олигомерными, а отдельные цепи — протомерами.
ОСОБЕННОСТИ СТРОЕНИЯ И ФУНКЦИОНИРОВАНИЯ ОЛИГОМЕРНЫХ БЕЛКОВ
1.Олигомерные белки могут содержать разное количество протомеров (например, димеры, тетра-меры, гексамеры и т. д.).
2. В состав олигомерных белков могут входить одинаковые или разные протомеры, например го-модимеры - белки содержащие 2 одинаковых протомера, гетеродимеры - белки, содержащие 2 разных протомера.
3. Различные по структуре протомеры могут связывать разные лиганды.
4. Взаимодействие одного протомера со специфическим лигандом вызывает конформационные изменения всего олигомерного белка и изменяет сродство других протомеров к лигандам. Это явление носит название кооперативных изменений конформации протомеров.
5. У олигомерных белков появляется новое по сравнению с одноцепочечными белками свойство — способность к аллостерической регуляции их функций.
Гемоглобин — олигомерный белок, функция которого регулируется различными лигандами.
1.Гемоглобин (НЬ) — сложный олигомерный белок, содержащийся в эритроцитах. Он состоит из 4 протомеров, соединенных нековалентными связями.
2. НЬ — белок, родственный миоглобину. Вторичная и третичная структуры миоглобина и протомеров НЬ очень сходны, несмотря на то что в первичной структуре полипептидных цепей идентичны только 24 аминокислотных остатка (каждый протомер содержит 8 ос-спиралей, обозначаемых буквами от А до Н).
Следовательно, белки, значительно различающиеся по аминокислотной последовательности, могут приобретать сходные пространственные структуры.
3. Каждый протомер НЬ в белке связан с небелковой частью — гемом и 3 другими протомерами.
4. Соединение белковой части НЬ с гемом аналогично таковому у миоглобина: гидрофобные части гема окружены гидрофобными радикалами аминокислот, за исключением Гис F8 и Гис Е7, которые расположены по обе стороны от плоскости гема и играют важную роль в связывании гемоглобина с 02.
Вопрос 11
Ферментативный катализ – каталитические реакции, протекающие с участием ферментов – биологических катализаторов белковой природы. Ферментативный катализ имеет две характерные особенности:
1. Высокая активность, на несколько порядков превышающая активность неорганических катализаторов, что объясняется очень значительным снижением энергии активации процесса ферментами.
2. Высокая специфичность. Например, амилаза катализирует процесс расщепления крахмала, представляющего собой цепь одинаковых глюкозных звеньев, но не катализирует гидролиз сахарозы, молекула которой составлена из глюкозного и фруктозного фрагментов.
Специфичность действия ферментов:
1. Субстратная (по отношению к субстрату)
- абсолютная
( Е действует на 1 субстрат)
Сахароза +Н2О -> α-глю + β-фру
-относительная (групповая)
(Е действует на сходные по строению субстраты)

-стереоспецифичность
(Е действует только на 1 стереоизомер)
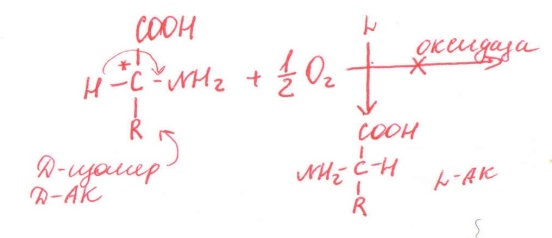
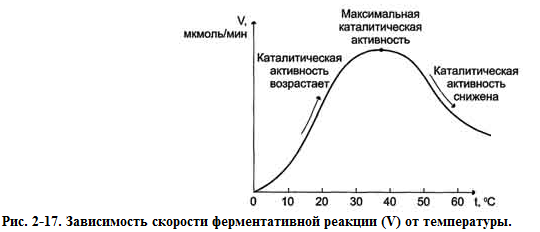
При увеличении температуры разрываются гидрофобные связи в ферменте и изменяется его активность.
При изменении pH меняется знак и величина заряда моногенных групп остатков АК.
При проведении ферментативной реакции в условиях избытка субстрата скорость реакции будет зависеть от концентрации фермента. Графическая зависимость такой реакции имеет вид прямой линии.
Km =(k-1 + k2)/k1 характеризует степень связывания фермента с субстратом
Чем меньше Km, тем больше сродство фермента с субстратом
Уравнение Михаэлиса- Ментен:
Вопрос 12
Кофакторы ферментов.
Многим ферментам для эффективной работы требуются те или иные небелковые компоненты, называемые кофакторами. Кофакторы — это вещества, присутствие которых совершенно необходимо для проявления каталитической активности ферментов, хотя сами они в отличие от ферментов сохраняют стабильность при довольно высоких температурах.
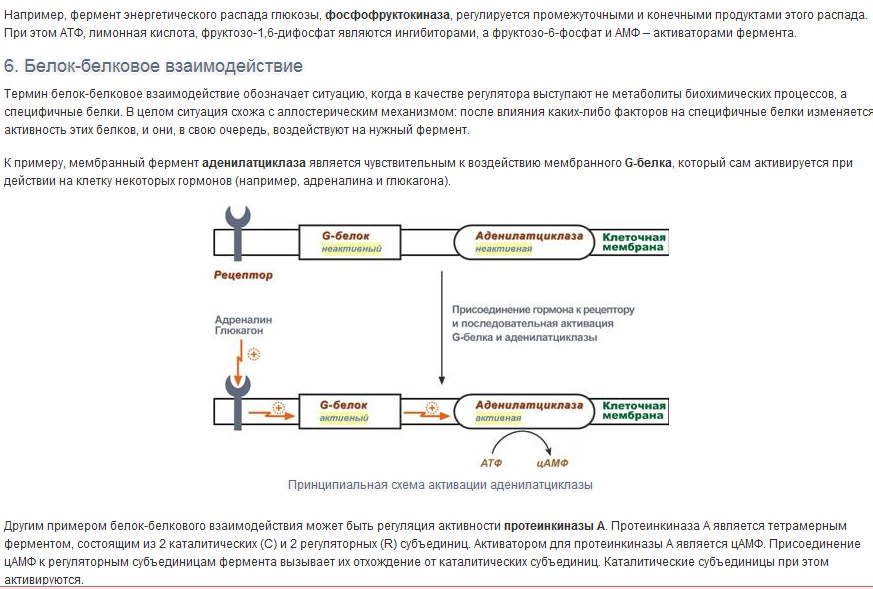
Роль кофакторов могут играть различные вещества — от простых неорганических ионов до сложных органических молекул; в одних случаях они остаются неизменными в конце реакции, в других — регенерируют в результате того или иного последующего процесса. Кофакторы подразделяются на три типа: неорганические ионы, простетические группы и коферменты.
две функции коферментов: непосредственное участие в каталитическом превращении субстрата, активирование и перенос молекулы субстрата или ее части от одного фермента к другому.
Витамины участвуют в осуществлении обеих этих функций коферментов. Они входят в состав ферментных систем, катализирующих различные типы химических реакций: переноса атомов водорода (электронов); переноса химических групп; синтеза, изомеризации и расщепления углеродных связей.
Вопрос 13
Ингибиторы – вещества, которые уменьшают активность ферментов и замедляют хими ческие реакции. Различают обратимое и необратимое ингибирование:
Если ингибитор связывается с молекулой фермента слабыми связями (Е+И ↔ ЕИ) то такой ингибитор легко удаляется и активность фермента восстанавливается;
Если ингибитор связывается с молекулой фермента прочными ковалентными связями (Е+И→ ЕИ), то наступает необратимое подавление активности фермента
В качестве ингибиторов ферментов по конкурентному механизму в медицинской практике используют вещества, называемые антиметаболитами. Эти соединения, будучи структурными аналогами природных субстратов, вызывают конкурентное ингибирование ферментов, с одной стороны, и, с другой - могут использоваться этими же ферментами в качестве псевдосубстратов, что приводит к синтезу аномальных продуктов.
В качестве лекарственных препаратов используют следующие антиметаболиты: сульфаниламидные препараты (аналоги парааминобензойной кислоты), применяемые для лечения инфекционных заболеваний, аналоги нуклеотидов для лечения онкологических заболеваний
Вопрос 14



Вопрос 15
Использование ферментов в качестве терапевтических средств имеет много ограничений вследствие их высокой иммуногениости. Тем не менее энзимотерапию активно развивают в следующих направлениях:
1. заместительная терапия - использование ферментов в случае их недостаточности;
2. элементы комплексной терапии - применение ферментов в сочетании с другой терапией.
Заместительная энзимотерапия эффективна при желудочно-кишечных заболеваниях, связанных с недостаточностью секреции пищеварительных соков. Например, пепсин используют при ахилии, гипо- и анацидных гастритах. Дефицит панкреатических ферментов также в значительной степени может быть компенсирован приёмом внутрь препаратов, содержащих основные ферменты поджелудочной железы (фестал, энзистал, мезим-форте и др.).
В качестве дополнительных терапевтических средств ферменты используют при ряде заболеваний. Протеолитические ферменты (трипсин, химотрипсин) применяют при местном воздействии для обработки гнойных ран с целью расщепления белков погибших клеток, для удаления сгустков крови или вязких секретов при воспалительных заболеваниях дыхательных путей. Ферментные препараты рибонуклеазу и дезоксирибонуклеазу используют в качестве противовирусных препаратов при лечении аденовирусных конъюнктивитов, герпетических кератитов.
Ферментные препараты стали широко применять при тромбозах и тромбоэмболиях. С этой целью используют препараты фибринолизина, стрептолиазы, стрептодеказы, урокиназы.
Фермент гиалуронидазу (лидазу), катализирующий расщепление гиалуроновой кислоты, используют подкожно и внутримышечно для рассасывания контрактур рубцов после ожогов и операций (гиалуроновая кислота образует сшивки в соединительной ткани) .
Ферментные препараты используют при онкологических заболеваниях. Аспарагиназа, катализирующая реакцию катаболизма аспарагина, нашла применение для лечения лейкозов.


Вопрос 9
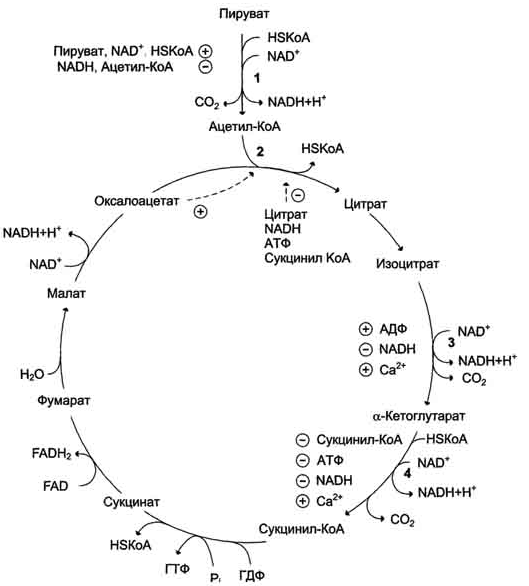
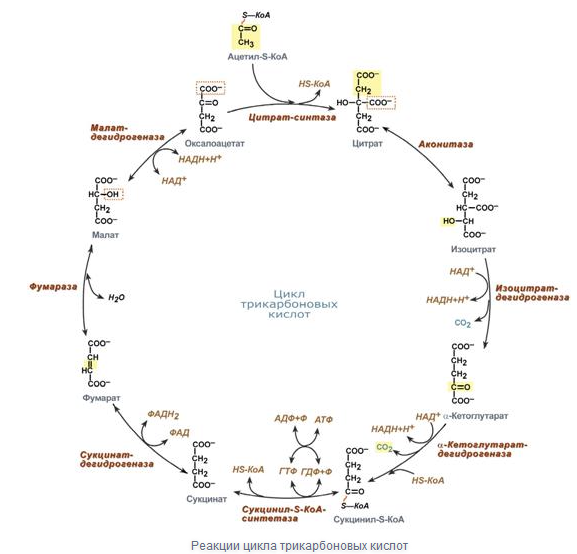
Анаболизм – совокупность процессов биосинтеза более сложных из простых веществ, требующий затраты энергии.
Катаболизм – процесс распада сложных соединений до более простых, это энергообразующая часть.
Этапы превращения энергии в живых организмах????
Сопряженное окисление связано с переходом свободной энергии, выделяющейся в процессе биологического окисления, в доступную для использования форму энергии — макроэргические связи АТФ или другие виды энергии, например ионный градиент. Различают такие виды сопряженного окисления, как субстратное фосфорилирование и окислительное фосфорилирование.
Субстратное фосфорилирование — это синтез АТФ за счет переноса высокоэнергетического ортофосфата (Н3Р04) от окисляемого субстрата на АДФ. Такое фосфорилирование происходит в основном в мышцах при анаэробном окислении глюкозы с участием высокоспецифических ферментов. Примером может служить окисление 2-фосфоглицериновой кислоты в процессе превращения ее в пировиноградную кислоту. Механизм образования АТФ в этой реакции связан с внутримолекулярным окислением 2-фосфоглицериновой кислоты и превращением ее в макроэргическое соединение — фосфоэнолпировиноградную кислоту:
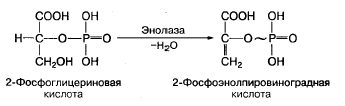
Фосфоэнолпировиноградная кислота благодаря ферменту пируваткиназе способна передавать высокоэнергетический фосфат на АДФ с образованием АТФ и пировиноградной кислоты:

За счет реакций субстратного фосфорилирования образуется сравнительно небольшое количество АТФ в клетке.
Окислительное фосфорилирование — это синтез АТФ за счет энергии, которая выделяется при переносе электронов по дыхательной цепи от окисляемых питательных веществ к атомарному кислороду. Окислительное фосфорилирование является основным механизмом образования АТФ в аэробных условиях.
Субстратное фосфорилирование и окислительное фосфорилирование характеризуются разной степенью сопряженности между реакциями, протекающими с освобождением и накоплением энергии. При субстратном фосфорилировании окисление тесно связано с образованием первичного макроэргического соединения. При окислительном фосфорилировании окисление в дыхательной цепи непосредственно не связано с синтезом АТФ и первоначально используется для образования протонного потенциала, который в дальнейшем приводит к синтезу АТФ. Энергия протонного потенциала может затрачиваться и на другие виды работы, поэтому образование АТФ не является единственным и обязательным следствием окисления.
Вопрос 8
Организация дыхательной цепи в митохондриях
Основные переносчики электронов встроены во внутреннюю мембрану митохондрий и организованы в 4 комплекса, расположенных в определённой последовательности (векторно). В этой последовательности их стандартные окислительно-восстановительные потенциалы становятся более положительными по мере приближения к кислороду (табл. 6-3, рис. 6-11).
Каждое звено этой цепи специфично в отношении донора и акцептора электронов.
На первом этапе дегидрогеназы катализируют отщепление водорода от различных субстратов. Если субстратами служат а-гидрокси-кислоты малат, изоцитрат, 3-гидроксибутират, водород переносится на NAD+. Образовавшийся NADH в дыхательной цепи, в свою очередь, окисляется NADH-дегидрогеназой (комплекс I).
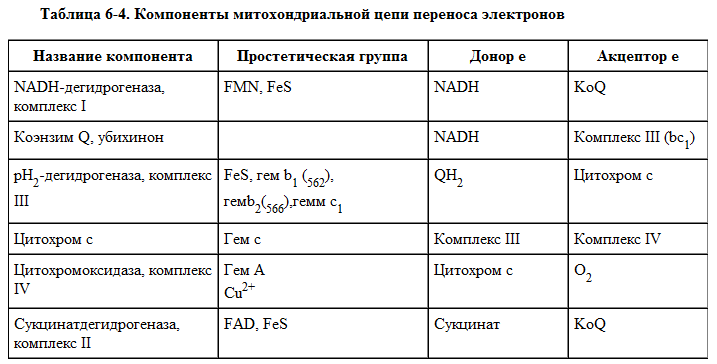
Если субстратом служат такие соединения, как сукцинат или глицерол-3-фосфат, акцептором водорода служат FAD-зависимые дегидрогеназы. От NADH и FADH2 электроны и протоны передаются на убихинон и далее через цепь цитохромов к молекулярному кислороду.
До сих пор точно неизвестно, каким образом расположены все переносчики электронов дыхательной цепи. Однако установлено, что в расположении дыхательных комплексов существует определённая асимметрия: некоторые из белков-переносчиков находятся ближе к той стороне внутренней мембраны, которая обращена к матриксу, а другие - к противоположной; некоторые белки пронизывают мембрану насквозь
Вопрос 10
Так как электроны всегда стремятся переходить от электроотрицательных систем к электроположительным, их транспорт по ЦПЭ к кислороду сопровождается снижением свободной энергии.
При сравнении величин электрохимических потенциалов переносчиков электронов (табл. 6-3) видно, что снижение свободной энергии происходит на каждом этапе ЦПЭ, и энергия электронов выделяется порциями.
Вместе с тем в дыхательной цепи можно выделить 3 участка, в которых перенос электронов сопровождается относительно большим снижением свободной энергии (рис. 6-11). Эти этапы способны обеспечить энергией синтез АТФ, так как количество выделяющейся свободной энергии приблизительно равно энергии, необходимой для синтеза АТФ из АДФ и фосфата. Экспериментально было подтверждено, что процесс переноса электронов по ЦПЭ и синтез АТФ энергетически сопряжены.
Первый процесс - перенос электронов от восстановленных коферментов NADH и FADH2 через ЦПЭ на кислород - экзергонический. Например:
NADH + Н+ +1/2 O2 → NAD+ + H2O + 52 ккал/моль(≈220 кДж/моль). (1)
Второй процесс - фосфорилирование АДФ, или синтез АТФ, - эндергонический:
АДФ + Н3РО4+7,3 ккал/моль (30,5 кДж/моль) = АТФ + Н2О. (2)
Синтез АТФ из АДФ и Н3РО4 за счёт энергии переноса электронов по ЦПЭ называют окислительным фосфорилированием.


ТЕМА 5.5. ДЫХАТЕЛЬНЫЙ КОНТРОЛЬ
Перенос электронов по ЦПЭ и синтез АТФ тесно сопряжены, т.е. могут происходить только одновременно и синхронно.
При увеличении расхода АТФ в клетке увеличивается количество АДФ и его поступление в митохондрии. Повышение концентрации АДФ (субстрата АТФ-синтазы) увеличивает скорость синтеза АТФ. При этом снижается протонный градиент, что стимулирует окисление первичных доноров и увеличивает скорость переноса электронов по ЦПЭ. Перенос электронов сопровождается увеличением поглощения кислорода, транспорта протонов из матрикса в межмембранное пространство и повышением протонного градиента, необходимого для активации АТФ-синтазы. Таким образом, скорость синтеза АТФ точно соответствует потребности клетки в энергии. Ускорение тканевого дыхания и окислительного фосфорилирования при повышении концентрации AДФ называется дыхательным контролем.
В реакциях ЦПЭ часть энергии не превращается в энергию макроэргических связей АТФ, а рассеивается в виде теплоты.
Вопрос 11

Вопрос 12


Вопрос 7. 


Вопрос 16
Переваривание углеводов
Переваривание это процесс гидролиза веществ до их ассимилируемых форм. Переваривание бывает: 1). Внутриклеточное (в лизосомах); 2). Внеклеточное (в ЖКТ): а). полостное (дистантное); б). пристеночное (контактное).
Переваривание углеводов в ротовой полости (полостное)
В ротовой полости пища измельчается при пережёвывании и смачивается слюной. Слюна состоит на 99% из воды и обычно имеет рН 6,8. В слюне присутствует эндогликозидаза α-амилаза (α-1,4-гликозидаза), расщепляющая в крахмале внутренние α-1,4-гликозидные связи с образованием крупных фрагментов — декстринов и небольшого количества мальтозы и изомальтозы. Необходим ион Cl-.
Переваривание углеводов в желудке (полостное)
Действие амилазы слюны прекращается в кислой среде (рН <4) содержимого желудка, однако, внутри пищевого комка активность амилазы может некоторое время сохраняться. Желудочный сок не содержит ферментов, расщепляющих углеводы, в нем возможен лишь незначительный кислотный гидролиз гликозидных связей.
Переваривание углеводов в тонком кишечнике (полостное и пристеночное)
В двенадцатиперстной кишке кислое содержимое желудка нейтрализуется соком поджелудочной железы (рН 7,5—8,0 за счет бикарбонатов). С соком поджелудочной железы в кишечник поступает панкреатическая α-амилаза. Эта эндогликозидаза гидролизует внутренние α-1,4-гликозидные связи в крахмале и декстринах с образованием мальтозы (2 остатка глюкозы, связанные α-1,4-гликозидной связью), изомальтозы (2 остатка глюкозы, связанные α-1,6-гликозидной связью) и олигосахаридов, содержащих 3—8 остатков глюкозы, связанных α-1,4- и α-1,6-гликозидными связями.
Переваривание мальтозы, изомальтозы и олигосахаридов происходит под действием специфических ферментов - экзогликозидаз, образующих ферментативные комплексы. Эти комплексы находятся на поверхности эпителиальных клеток тонкого кишечника и осуществляют пристеночное пищеварение.
Сахаразо-изомальтазный комплекс состоит из 2 пептидов, имеет доменное строение. Из первого пептида образован цитоплазматический, трансмембранный (фиксирует комплекс на мембране энтероцитов) и связывающий домены и изомальтазная субъединица. Из второго - сахаразная субъединица. Сахаразная субъединица гидролизует α-1,2-гликозидные связи в сахарозе, изомальтазная субъединица - α-1,6-гликозидные связи в изомальтозе, α-1,4-гликозидные связи в мальтозе и мальтотриозе. Комплекса много в тощей кишке, меньше в проксимальной и дистальной частях кишечника.
Гликоамилазный комплекс, содержит две каталитические субъединицы, имеющие небольшие различия в субстратной специфичности. Гидролизует α-1,4-гликозидные связи в олигосахаридах (с восстанавливающего конца) и в мальтозе. Наибольшая активность в нижних отделах тонкого кишечника.
β-Гликозидазный комплекс (лактаза) гликопротеин, гидролизует β-1,4-гликозидные связи в лактозе. Активность лактазы зависит от возраста. У плода она особенно повышена в поздние сроки беременности и сохраняется на высоком уровне до 5-7-летнего возраста. Затем активность лактазы снижается, составляя у взрослых 10% от уровня активности, характерного для детей.
Трегалаза гликозидазный комплекс, гидролизует α-1,1-гликозидные связи между глюкозами в трегалозе — дисахариде грибов.
Переваривание углеводов заканчивается образованием моносахаридов – в основном глюкозы, меньше образуется фруктозы и галактозы, еще меньше – маннозы, ксилозы и арабинозы.
Всасывание углеводов
Моносахариды всасываются эпителиальными клетками тощей и подвздошной кишок. Транспорт моносахаридов в клетки слизистой оболочки кишечника может осуществляться путём диффузии (рибоза, ксилоза, арабиноза), облегчённой диффузии с помощью белков переносчиков (фруктоза, галактоза, глюкоза), и путем вторично-активного транспорта (галактоза, глюкоза). Вторично-активный транспорт галактозы и глюкозы из просвета кишечника в энтероцит осуществляется симпортом с Na+. Через белок-переносчик Na+ двигается по градиенту своей концентрации и переносит с собой углеводы против их градиента концентраций. Градиент концентрации Na+ создаётся Nа+/К+-АТФ-азой.
При низкой концентрации глюкозы в просвете кишечника она транспортируется в энтероцит только активным транспортом, при высокой концентрации - активным транспортом и облегчённой диффузией. Скорость всасывания: галактоза > глюкоза > фруктоза > другие моносахариды. Моносахариды выходят из энтероцитов в направлении кровеносного капилляра с помощью облегченной диффузии через белки-переносчики.
Дата добавления: 2015-04-18; просмотров: 298; Мы поможем в написании вашей работы!; Нарушение авторских прав |