
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Измерение ЭДС Е химических источников тока. Измерение равновесных электродных потенциалов φ.
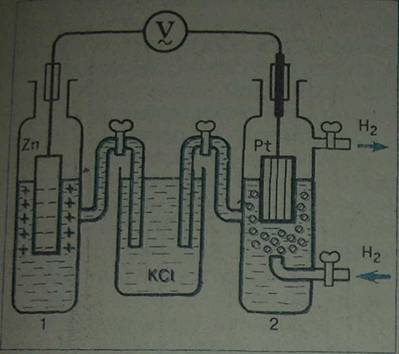
Рис. Электрохимическая цепь со стандартным водородным электродом (справа) для определения электродного потенциала исследуемого электрода (слева). 1- исследуемый электрод (в данном случае цинковый электрод); 2 – стандартный водородный электрод; V – высокоомный вольтметр или компенсационная схема (они обеспечивают условие I ≈ 0). Для замыкания электрической цепи между водородным и исследуемым электродами расположен электролитический мостик- стаканчик с раствором КСI.
Потенциометрический анализ (анализ без наложения внешнего источника напряжения). При потенциометрических измерениях электрохимическая ячейка включает два электрода – индикаторный (рабочий) электрод и электрод сравнения. Величина ЭДС, возникающая в ячейке, равна разности потенциалов этих двух электродов. Поскольку потенциал электрода сравнения в условиях проведения потенциометрического измерения остается постоянным, то изменение ЭДС зависит только от изменения потенциала индикаторного электрода, т.е. от активности тех или иных ионов в растворе. На этом основано потенциометрическое определение концентрации данного вещества в анализируемом растворе.
Для потенциометрического определения концентрации вещества в растворе используют как прямую потенциометрию, так и потенциометрическое титрование (косвенный метод). Второй способ используется чаще. [1], c. 452
Пример прямой потенциометрии – определение в водных растворах концентраций анионов, катионов металлов, катионов водорода (рН). При определении рН растворов в качестве индикаторного (рабочего) используют электроды, потенциал которых зависит от концентрации ионов водорода: это мембранный стеклянный электрод, водородный электрод и некоторые другие. Чаще используют мембранный стеклянный электрод. [1], c. 453.
Потенциометрия прямая.
Водородный электрод. Определение рН растворов. Полуреакция, протекающая на водородном электроде, описывается уравнением Н+(водн) + е = ½ Н2(г.). Концентрация ионов водорода в водородном электроде связана с его электродным потенциалом уравнением Нернста
 , (*)
, (*)
где  - парциальное давление газообразного водорода над раствором.
- парциальное давление газообразного водорода над раствором.
Если предположить, что парциальное давление газообразного водорода равно 1 атм., и учесть, что по соглашению  = 0, то уравнение (*) сведется к следующему
= 0, то уравнение (*) сведется к следующему  .
.
Поскольку рН = -  , находим
, находим
 .
.
Таким образом, электродный потенциал водородного электрода прямо пропорционален рН. Если собрать электрохимический источник тока, состоящий из водородного электрода и какого-либо другого электрода, например, каломельного электрода, электродный потенциал которого не зависит от концентрации ионов водорода, то можно показать, что ЭДС такого источника тока пропорционален рН, т.е. Еист ∞ рН. Таким образом, электрохимический источник тока, состоящий из электрода, чувствительного к концентрации ионов водорода, и какого - либо электрода сравнения, может служить удобным прибором для определения рН. Однако, на практике вместо водородного электрода для определения рН используется мембранный стеклянный электрод.
Мембранный стеклянный электрод. Применение. Калибровка. Стеклянный электрод представляет собой тонкостенную стеклянную колбочку, наполненную насыщенным раствором хлорида серебра AgCI в соляной кислоте HCI с концентрацией 0.1 моль/л. В колбочку впаяна серебряная проволочка. Стеклянный электрод вместе с каким-либо электродом сравнения (например, хлоридсеребряным электродом) погружаются в анализируемый раствор. Электродный потенциал стеклянного электрода пропорционален концентрации ионов водорода в анализируемом растворе. ЭДС химического источника тока, состоящего из стеклянного электрода и электрода сравнения, может быть измерена с помощью высокоомного вольтметра. Если такой высокоомный вольтметр отградуирован таким образом, что на его шкале указаны значения рН, и подключен к стеклянному электроду и электроду сравнения, получается прибор, который называют рН-метром. Для калибровки рН - метра используют набор буферных растворов с точно известными значениями рН. [3], с. 506.
Ионселективные электроды (ИСЭ).Потенциометрия с ионселективными электродами. ИСЭ позволяют определять ионы F-, Cl-, Br-, I-, CN-, SCN-, NO3-, NO2-, ClO4-, S2-, Na+, K+, Ca2+, Ag+, Cu2+, Cd2+, Pb2+ в интервалах концентраций от n ∙10-2 до n ∙10-7 моль/л. Метод наиболее часто используется для контроля вод, атмосферы.
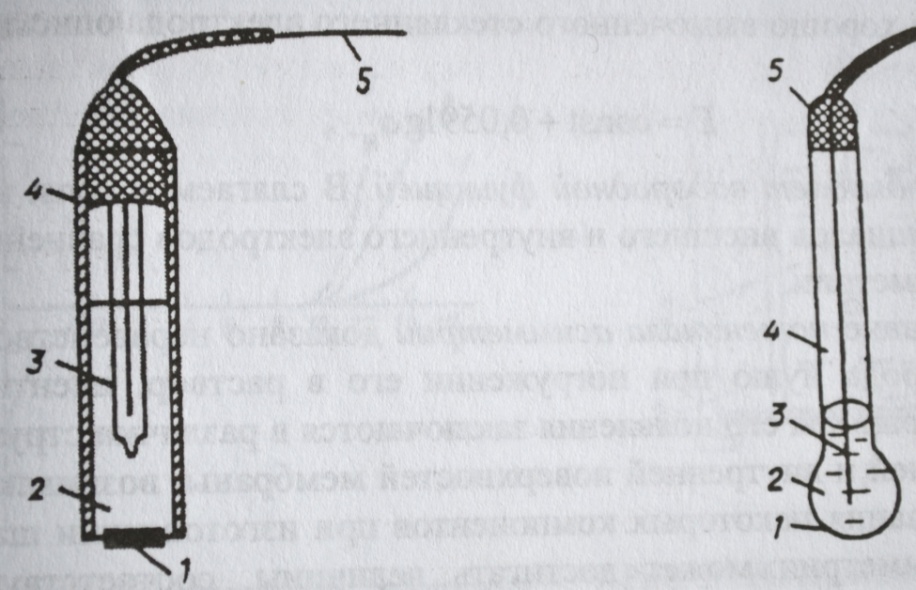
Рисунок слева. Фторид-селективный электрод: 1 – пластинка из LaF3; 2 – внутренний стандартный раствор NaF + NaCI; 3 – внутренний электрод сравнения;4 – изоляция; 5 – токоотвод. Рисунок справа. Стеклянный электрод для измерения рН: 1 – тонкая стеклянная рН-чувствительная мембрана; 2 – 0.1 М раствор НСI, насыщенный AgCI; 3 – серебряная проволока; 4 – стеклянная трубка; 5 – изоляция; 6 – токоотвод.
Потенциометрическое титрование, схема опыта, кривая зависимости Е от суммарного объема добавленного титранта. Потенциометрическое титрование (косвенный метод потенциометрического метода анализа) – способ определения объема титранта, затраченного на титрование определяемого вещества в анализируемом растворе, путем измерения ЭДС (в процессе титрования) с помощью гальванической цепи, составленной из индикаторного электрода и электрода сравнения. При потенциометрическом титровании анализируемый раствор, находящийся в электрохимической ячейке, титруют подходящим титрантом, фиксируя конец титрования (достижение точки эквивалентности) по резкому изменению ЭДС измеряемой цепи - потенциала индикаторного электрода, который зависит от концентрации соответствующих ионов и резко изменяется в точке эквивалентности. Электродную пару (индикаторный электрод и электрод сравнения) составляют так, чтобы потенциал индикаторного электрода зависел от концентрации ионов, участвующих или образующихся в реакции, протекающей при титровании. Потенциал электрода сравнения во время титрования должен оставаться постоянным. Оба электрода устанавливают непосредственно в электрохимической ячейке или же помещают в отдельные сосуды с токопроводящими растворами (индикаторный электрод – в анализируемый раствор), которые соединяют электролитическим мостиком, заполненным индифирентным электролитом. [1], c.454.
Потенциометрическое титрование основно-кислотное. схема опыта, кривая зависимости Е от суммарного объема добавленного титранта Пример. При кислотно-основном титровании используют стеклянный электрод и электрод сравнения. Поскольку стеклянный электрод чувствителен к изменениям рН среды, при титровании на потенциометре регистрируется изменение рН среды. Кислотно-основное потенциометрическое титрование применяют при титровании кислот и оснований.
Потенциометрическое титрование с использованием реакции осаждения. Схема опыта, кривая зависимости Е от суммарного объема добавленного титранта Пример. При осадительном потенциометрическом титровании применяют в качестве индикатора электрод из металла, составляющего с определяемыми ионами электродную пару. Для осадительного титрования используется ионоселективный электрод в сочетании с каким-либо электродом сравнения. Например, для титрования хлорида калия KCI нитратом серебра AgNO3
Ag+(водн.) + Cl-(водн.) = АgCl(тв.)
применяют серебряный электрод, селективный к ионам серебра.
Потенциометрическое титрование с использованием окислительно-восстановительных реакций.Схема опыта, кривая зависимости Е от суммарного объема добавленного титранта. Как определяется точка эквивалентности? Чему равен эквивалент вещества, участвующего в ОВР? Пример. При окислительно-восстановительном титровании применяют электрод сравнения (чаще каломельный электрод) и инертный металлический электрод - платиновый индикаторный электрод, чувствительный к окислительно-восстановительным парам. Окислители титруют восстановителями, а восстановители – окислителями. Процессы окислительно-восстановительного титрования представляют графически в виде кривых титрования, изображающих изменение окислительно-восстановительного потенциала титруемого раствора по мере приливания к нему стандартного раствора окислителя или восстановителя (титранта). При титровании изменяется соотношение окисленной и восстановленной форм определяемого вещества и титранта, поэтому потенциалы редокс-пар рассчитывают по уравнению Нернста. До точки эквивалентности потенциал рассчитывают по потенциалу пары определяемого вещества, а после точки эквивалентности – по потенциалу пары титранта.
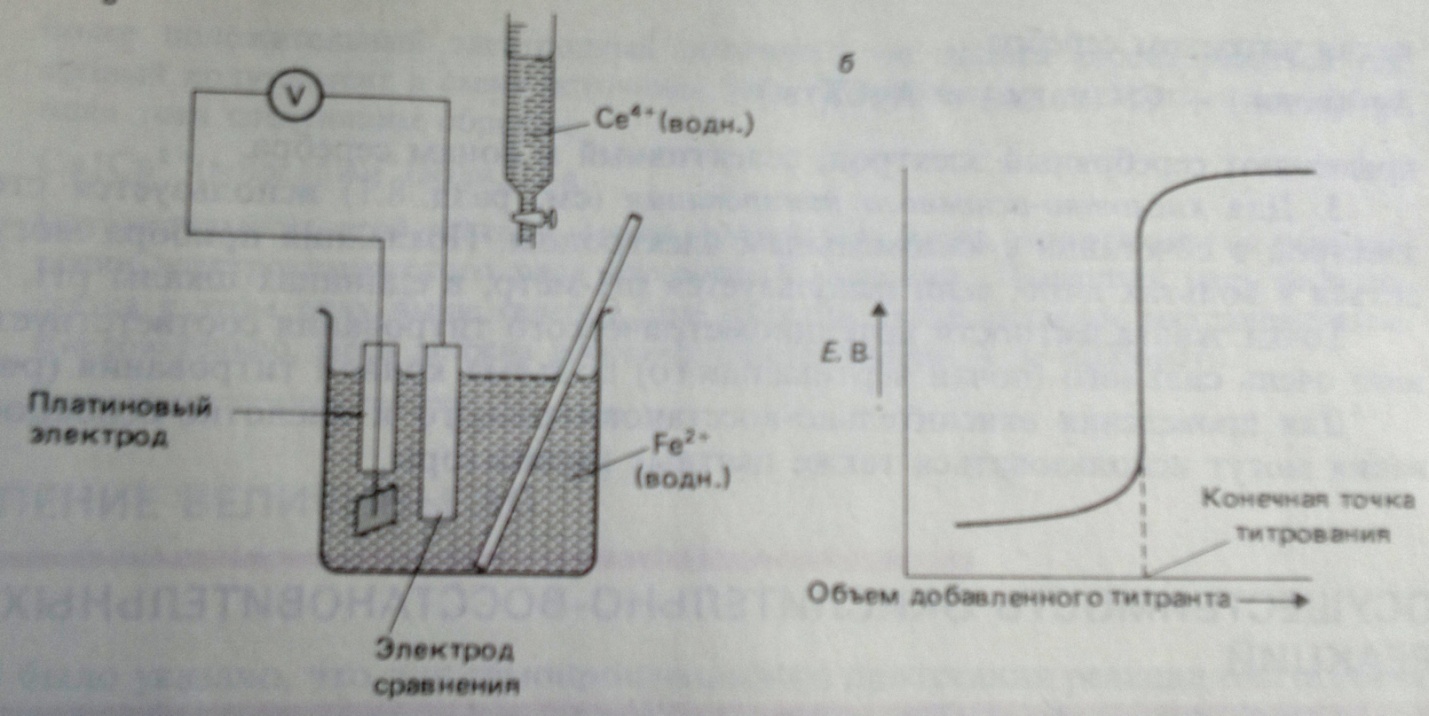
Рис. Потенциометрическое титрование. Слева: титрование ионов Fe2+ ионами Ce4+ по реакции Fe2+(водн.) + Ce4+(водн.) = Fe3+(водн.) + Ce3+(водн.). Справа: типичная кривая Е – V потенциометрического титрования. [Фримантл.], т.1, с.507.
Потенциометрическое титрование. Способы нахождения конечной точки титрования.Обобщение.
Для нахождения точки эквивалентности кривые потенциометрического титрования строят в различных координатах:
- интегральные кривые титрования в координатах Е(ордината) – V(абсцисса) ;
- дифференциальные кривые титрования в координатах ∆E/∆V – V и ∆2E/∆V2 – V;
где Е – ЭДС потенциометрической ячейки; ∆V- объем добавленного титранта; V – суммарный объем добавленного титранта; ∆E- изменение потенциала, соответствующее добавлению ∆V раствора титранта.
По построенным кривым определяют суммарный объем добавленного титранта V(ТЭ) в точке эквивалентности, и затем рассчитывают количество или концентрацию определяемого вещества.
Как выглядят графики зависимостей в координатах Е – V , ∆E/∆V – V, ∆2E/∆V2 – V.
Как по этим графикам находят объем добавленного титранта V(ТЭ) в точке эквивален -тности.

Рис. Графический способ нахождения конечной точки титрования: а – интегральная кривая; б – первая производная; в – вторая производная.
Кондуктометрический анализ(метод с наложенным внешним источником тока)
Дата добавления: 2015-04-21; просмотров: 517; Мы поможем в написании вашей работы!; Нарушение авторских прав |