
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Более простое и краткое изложение материала
Электрический потенциал.Электрический потенциал – величина, численно равная работе по перемещению единичного положительного заряда из данной точки пространства в другую с потенциалом 0 В. Каждый электрод обладает каким-то электрическим потенциалом. Абсолютное значение потенциала электрода определить нельзя. Можно лишь сравнивать потенциалы различных электродов друг с другом. Для этого надо два электрода (полуэлемента) объединить в электрохимическую цепь. Металлические части соединяются проводником, а растворы электролитов, в которые они погружены - стеклянной трубкой с раствором электролита (хлорида калия). Чтобы раствор не выливался из трубки, ее концы закрывают пористыми ватными жгутами. Такую трубку называют электролитическим ключом или солевым мостиком. Она обеспечивает ионную проводимость между полуэлементами. Так возникает замкнутая цепь или гальванический элемент (ГЭ). Пример такого ГЭ показан на рис. 1. Разность электрических потенциалов двух электродов в такой цепи при отсутствии тока (I = 0) называют электродвижущей силой цепи ЭДС Е.
Е = φкатод - φанод
Значение ЭДС может быть измерено с помощью высокоомного вольтметра, что позволяет сравнивать потенциалы электродов друг с другом. Обычно потенциалы отдельных электродов измеряют относительно потенциала стандартного водородного электрода. Его потенциал условно принимают равным нулю.
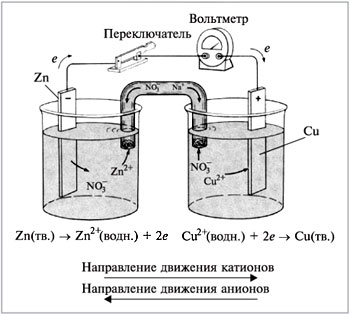
Рис. 1. Электрохимическая цепь или гальванический элемент, составленный из цинкового и из медного полуэлементов.
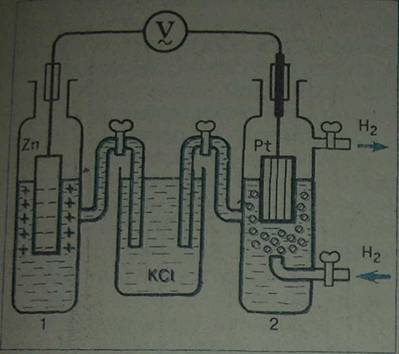
Рис. 2. Электрохимическая цепь (ГЭ) со стандартным водородным электродом: 2 –стандартный водородный электрод, 1 - исследуемый электрод, в центре – одна из разновидностей электролитического ключа.
Таким образом, электродным потенциалом называют ЭДС Е электрохимической цепи -гальванического элемента, составленного из исследуемого электрода и стандартного водородного электрода. Такая цепь изображена на рис. 2. Потенциал отдельного электрода обычно обозначают буквой 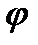 . Е =
. Е = 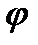 исследуемый электрод -
исследуемый электрод - 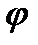 стандартный водородный электрод ,
стандартный водородный электрод , 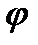 стандартный водородный электрод = 0 В,
стандартный водородный электрод = 0 В, 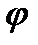 исследуемый электрод = Е
исследуемый электрод = Е
Электрод, относительно которого измеряется потенциал, называется электродом сравнения. Кроме водородного, в качестве электродов сравнения используют стандартный хлорсеребряный (+ 0.1988 В в водородной шкале), стандартный каломельный (+ 0.2444 В в водородной шкале) и некоторые другие. Во всех случаях потенциал электрода сравнения принимается равным нулю. Можно перейти от одной шкалы потенциалов к другой. Например, по водородной щкале стандартный равновесный потенциал цинкового электрода равен - 0,76 В, а потенциал хлорсеребряного электрода + 0,22 В. Следовательно, потенциал цинкового электрода по шкале хлорсеребряного электрода будет равен:
- 0,76 - (+ 0,22) = - 0,98 В, а по шкале каломельного -.076 – (0.2415) = - 1.0015 В
Zn2+/Zn H+/H2 AgCI/Ag Hg2CI2/Hg
_______│____________│______│__________│__
Водородная шкала: -0.76 0 +0.22 В +0.2415 В
Дата добавления: 2015-04-21; просмотров: 386; Мы поможем в написании вашей работы!; Нарушение авторских прав |