
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кондуктометрический анализ, кондуктометрическая ячейка, постоянная кондуктометрической ячейки.

Рис. Кондуктометрическая ячейка.
Кондуктометрический анализ основан на использовании зависимости между электропроводностью (электрической проводимостью) водных растворов электролитов и их концентрацией. Об электропроводности растворов электролитов судят на основании измерения их электрического сопротивления в электрохимической ячейке, которая представляет собой стеклянный стакан с двумя опущенными в него электродами, между которыми и находится испытуемый раствор электролита. Такая ячейка называется кондуктометром. Во избежание осложнений, связанных с процессами электролиза, через ячейку пропускают переменный электрический ток. Электрическое сопротивление R слоя раствора электролита, заключенного между электродами, прямо пропорционально толщине l этого слоя (расстоянию между электродами) и обратно пропорционально площади S поверхности электродов  ,
,
где коэффициент пропорциональности ρ называют удельным электрическим сопротивлением, а обратную величину κ = 1/ρ – удельной электропроводностью раствора электролита. Удельная электропроводность зависит от природы электролита и растворителя, от концентрации раствора, от температуры. Отношение l/S называют постоянной кондуктометрической ячейки.
Определение концентрации растворов осуществляют прямой кондуктометрией и кондуктометрическим титрованием. Прямая кондуктометрия используется для определения концентрации раствора по калибровочному графику. Для составления калибровочного графика замеряют электрическую проводимость серии растворов электролита с известной концентрацией и строят калибровочный график зависимости электрической проводимости от концентрации. Затем измеряют электрическую проводимость анализируемого раствора и по графику определяют его концентрацию. [1], c.467.
Физический смысл удельной электрической проводимости (удельной электропроводности) κ – это электрическая проводимость слоя электролита, находящегося между сторонами куба с длиной сторон 1 м, численно равная току, проходящему через слой раствора электролита с площадью поперечного сечения 1 м2 при градиенте приложенного электрического потенциала 1 В/м. Удельная электропроводность зависит от природы электролита и растворителя, от концентрации раствора, от температуры. [κ] = Ом-1∙ м-1. [1], c.458.
Физический смысл удельного электрического сопротивления ρ. (По аналогии с κ)
Обработка результатов измерений в методе прямой кондуктометрии.
Прямая кондуктометрия (прямой метод с внешним источником тока). Концентрацию вещества в анализируемом растворе определяют по результатам измерения удельной электропроводности κ этого раствора. При обработке данных измерений используют метод градуировочного графика.
Метод градуировочного графика для определения концентрации по результатам измерений. Готовят серию эталонных растворов, каждый из которых содержит точно известную концентрацию определяемого вещества, измеряют их удельную электропроводность при постоянной температуре в термостатируемой кондуктометрической ячейке. По полученным данным строят градуировочный график, откладывая по оси абсцисс концентрацию эталонных растворов, а по оси ординат – значения удельной электропроводности. Построенный график в относительно небольшом диапазоне изменения концентраций обычно представляет собой прямую линию. [1], c. 462.
Кондуктометрическое титрование (косвенный метод с внешним источником тока). Схема измерительной ячейки. Как определяется постоянная кондуктометрической ячейки? Кривые «электрическая проводимость раствора - объем добавленного титранта». Как определяется точка эквивалентности?

Рис. Схема измерительной ячейки для кондуктометрического титрования.
При кондуктометрическом титровании за ходом титрования следят по изменению электропроводности анализируемого раствора, находящегося в кондуктометрической ячейке между двумя инертными электродами (из платины). По полученным данным вычерчивают кривую кондуктометрического титрования, отражающую зависимость электропроводности κ титруемого раствора от суммарного объема V прибавленного титранта. Конечную точку титрования находят экстраполяцией участков кривой титрования в области изменения ее наклона. При этом не требуется индикаторов, изменяющих окраску вблизи точки эквивалентности (ТЭ). В кондуктометрическом титровании используют различные типы реакций: кислотно-основные, окислительно-восстановительные, реакции комплексообразования. Точность кондуктометрического титрования составляет 1%, но если принять меры по термостатированию анализируемого раствора, то точность определения можно в несколько раз увеличить. Типичный вид кривой кондуктометрического титрования представлен на рис.

|
Точка эквивалентности на графике находится пересечением двух прямых. Одна прямая (до точки эквивалентности) отражает изменение концентрации анализируемого иона и ионов титранта, а другая (после точки эквивалентности) является следствием увеличения концентрации ионов титранта. [1], c.464.
Вольтамперометрия (метод с наложением внешнего источника тока) и ее важный частный случай - полярография. Принцип метода. Потенциал полуволны (полярографической волны) и предельный диффузионный ток как аналитические сигналы. Схема устройства для проведения вольтамперометрического анализа.
В ранее рассмотренном методе потенциометрии аналитическим сигналом был потенциал рабочего электрода, зависящий от концентрации электроактивного вещества в анализируемом растворе. Т.е. в этом методе отсутствовал внешний источник тока. В методе вольтамперометрии изучаются кривые зависимости силы тока от накладываемого потенциала на рабочий (индикаторный) электрод. При этом потенциал навязывается от внешнего источника тока. На рис. ниже изображены двух- и трехэлектродная ячейки, используемые в вольтамперометрии. В качестве рабочего электрода используют инертный электрод (например, платиновый, ртутный), способный реагировать на присутствие в растворе любого электроактивного вещества. Теорию трехэлектродной ячейки мы опускаем.

Рис. Двухэлектродная (а) и трехэлектродная (б) ячейки для вольтамперометрии и полярографии. (РЭ – рабочий электрод, ВЭ – вспомогательный электрод, ЭС – электрод сравнения). Подробности см. в [Юинг], с.332.
Вольтамперометрия прямая. Метод прямой вольтамперометрии (полярографичес-кий анализ) основан на использовании следующих зависимостей между электрическими параметрами электрохимической (в данном случае – полярографической) ячейки, к которой прилагается внешний потенциал, и свойствами содержащегося в ней раствора. (Термин полярография относится только к вольтамперометрии с использованием ртутного капающего электрода. [2], c.331.)
а) В качественном полярографическом анализе используют связь между величиной приложенного на микроэлектроде (рабочем электроде РЭ) внешнего электрического потенциала V, при котором наблюдается восстановление (или окисление) анализируемого вещества на этом электроде (микроэлектроде) в данных условиях, и природой восстанавливающегося (или окисляющегося) вещества.
б) В количественном полярографическом анализе используют связь между величиной диффузионного электрического тока, устанавливающегося в полярографической ячейке после достижения определенного значения приложенного на микроэлектроде электрического потенциала, и концентрацией определяемого (восстанавливающегося или окисляющегося) вещества в анализируемом растворе. [1], c. 466
На рисунках ниже показано изменение электрического тока i, проходящего через полярографическую ячейку, как функции возрастающего потенциала Е, приложенного на ртутном капающем микрокатоде, - так называемая поляризационная, или вольт - амперная кривая. При постепенном повышении приложенного потенциала вначале электрический ток, обусловленный присутствием ионов фонового электролита, растворенного кислорода и восстанавливающихся возможных примесей, возрастает очень медленно - остается почти постоянным. Это так называемый остаточный ток (на рис. слева обозначен цифрой 1). При некотором значении потенциала, называемого потенциалом выделения, ток в ячейке резко возрастает (фарадеевский ток) и далее при сравнительно небольшом дальнейшем повышении потенциала достигает максимального, возможного в данных условиях значения, после чего снова изменяется мало (обозначен цифрой 2). Это так называемый предельный ток. Разность между предельным и остаточным током составляет диффузионный ток iD. [1], c.468.
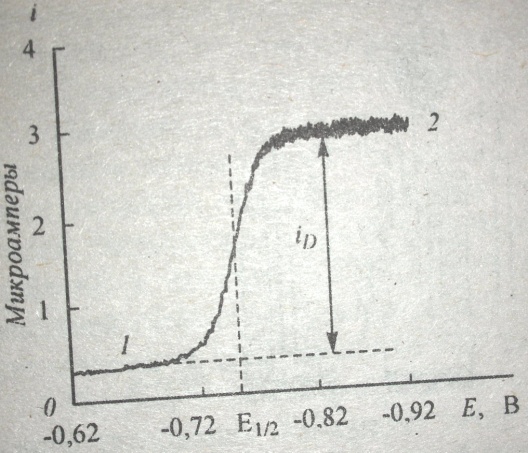

Рис. слева. Полярограмма водного щелочного 0.0005 моль/л раствора нитрата свинца при 25оС. По оси ординат отложена сила тока i , мкА; по оси абсцисс – потенциал Е, В. 1 - остаточный ток, 2 – предельный ток, iD – диффузионный ток, Е1/2 – потенциал полуволны. Значения потенциалов даны относительно насыщенного каломельного электрода.
Рис. справа. Полярограмма раствора, содержащего катионы свинца и кадмия. Е- приложенный потенциал относительно насыщенного каломельного электрода (к сожалению, фоновый электролит не указан). Из полярограммы видно, что свинец начнет выделяться из раствора на катоде первым при достижении потенциала - 0.4 В. При - 0.65 и ниже вместе со свинцом одновременно выделяется и кадмий. Развертку приложенного потенциала нужно сделать до того, как заметно изменятся концентрации анализируемых катионов.
Ниже на схеме показаны соотношения потенциалов выделения катионов Pb2+ и Cd2 при полярографическом их выделении из раствора в водородной шкале и в шкале относительно каломельного электрода. Для сравнения в средней строке приведены значения потенциалов выделения Pb2+ и Cd2+ в водородной шкале при стандартных условиях, когда [Pb2+] = [Cd2+] = 1 моль/л.
Cd2+/Cd Pb2+/Pb H+/H2 Hg2CI2/Hg
____│_________│_______│______________│__
Водородная шкала -0.409 -0.159 0 +0.241 В
(Стандартные потенц. в водородной шкале) -0.40 -0.126
Каломельная шкала -0.65 -0.4 -0.241 0 В
Аналитический сигнал в качественном полярографическом анализе. В качес-твенном полярографическом анализе полученный по полярограмме потенциал полуволны Е1/2 используется в качестве признака наличия в растворе определенного иона. Потенциал полуволны зависит от вида определяемого иона, а также от вида и концентрации ионов фонового электролита. Потенциалы полуволны для разных ионов и разных фоновых электролитов приводятся в справочниках. Ниже приведен фрагмент таблицы из справочника.
Аналитический сигнал в количественном полярографическом анализе. В количественном полярографическом анализе зависимость величины диффузионного тока iD от концентрации c восстанавливающегося вещества выражается уравнением Ильковича
iD = 607 ∙ n ∙ D1/2 ∙ m2/3 ∙ τ1/6 ∙ c. (*)
В cокращенном виде уравнение Ильковича имеет вид
iD = k ∙c.
Коэффициент пропорциональности k можно рассчитать по уравнению (*), но лучше оценить его по полярограмме стандартного раствора вещества. [2], c. 355.
Кулонометрический химический анализ (метод с наложением внешнего потенциала). Законы электролиза Фарадея. В кулонометрии количество определяемого вещества определяют измерением количества электричества, затраченное на их количественное электрохимическое превращение. Кулометрический анализ проводят в электролитической ячейке, в которую помещают раствор определяемого вещества. При подаче на электроды ячейки соответствующего потенциала (эти потенциалы для разных ионов даны в справочниках) происходит электрохимическое восстановление или окисление анализируемого вещества. Согласно законам электролиза Фарадея количество вещества, прореагировавшего на электроде, пропорционально количеству электричества, прошедшего через раствор. Пусть на электроде протекает полуреакция X ± ne = Y, где знак плюс относится к полуреакции на катоде, и минус – на аноде.
1- й закон Фарадея: m(Y) = k(Y) ∙I∙ t
2 - й закон Фарадея: k(Y) = M(Y)/n∙F
И суммарно: m(Y) = (M(Y) ∙I ∙ t) /(n∙F), где М(Y) – мольная масса вещества Y, кг/моль.
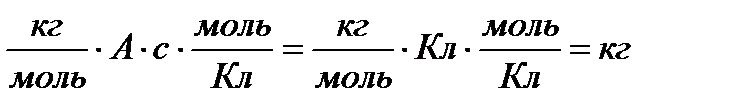
Дата добавления: 2015-04-21; просмотров: 1934; Мы поможем в написании вашей работы!; Нарушение авторских прав |