
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гомологический ряд предельных одноосновных карбоновых кислот. Строение карбоксильной группы. Химические свойства на примере уксусной кислоты.Применение.
Карбоновымикислотами называются соединения, содержащие карбоксильную группу

Строение. Карбоксильная группа СООН состоит из карбонильной группы С=О и гидроксильной группы ОН. Свойства карбоксильной группы отличаются от свойств составляющих ее групп, которые оказывают взаимное влияние друг на друга
Способы получения. 1. Окисление альдегидов и первичных спиртов — общий способ получения карбоновых кислот. В качестве окислителей применяются KМnО4 и K2Сr2О7.
| [O] | [O] | |||
| R-CH2-OH | → | R-CH=O | → | R-CO-OH |
| спирт | альдегид | кислота |
2. Гидролиз сложных эфиров:
R-COOR1 + КОН → R-COOK + R'OH ,
R-COOK + HCl → R-COOH + KCl .
3. Для отдельных кислот существуют специфические способы получения.
Муравьиную кислоту получают нагреванием оксида углерода (II) с порошкообразным гидроксидом натрия под давлением и обработкой полученного формиата натрия сильной кислотой:
| 200 °С, Р | H2SO4 | |||
| NaOH + СО | → | HCOONa | → | НСООН |
Уксусную кислоту получают каталитическим окислением бутана кислородом воздуха:
2С4Н10 + 5O2 → 4СН3СООН + 2Н2О.
Химические свойства. 1. В водном растворе карбоновые кислоты диссоциируют:
RCOOH 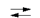 RCOO- + Н+
RCOO- + Н+
карбоновые кислоты — это, как правило, слабые кислоты.
Взаимное влияние атомов в молекулах дикарбоновых кислот приводит к тому, что они являются более сильными, чем одноосновные.
2. Образование солей. Карбоновые кислоты обладают всеми свойствами обычных кислот. Они реагируют с активными металлами, основными оксидами, основаниями и солями слабых кислот:
2RCOOH + Мg → (RCOO)2Mg + Н2,
2RCOOH + СаО → (RCOO)2Ca + Н2О,
RCOOH + NaOH → RCOONa + Н2О,
RCOOH + NaHCO3→ RCOONa + Н2О + СО2↑.
Карбоновые кислоты — слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей:
CH3COONa + HCl → СН3СООН + NaCl.
Отличие карбоновых кислот от минеральных заключается в возможности образования ряда функциональных производных.
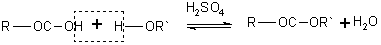
Сложные эфиры образуются при нагревании кислоты со спиртом в присутствии серной кислоты (обратимая реакция этерификации):
3. Окислительно-восстановительные реакции карбоновых кислот.
Карбоновые кислоты при действии восстановителей в присутствии катализаторов способны превращаться в альдегиды, спирты и даже углеводороды:
| 2[Н] | ||
| СН3СООН | → | СН3СНО + Н2О |
| 4[Н] | ||
| СН3СООН | → | СН3СН2ОН + Н2О |
| 6[Н] | ||
| СН3СООН | → | С2Н6 + 2Н20 |
Она дает реакцию "серебряного зеркала":
CН3 НСООН + Аg2О → 2Аg + СО2 + Н2О.
В атмосфере кислорода карбоновые кислоты окисляются до СО2 и Н2О:
СН3СООН + 2О2 → 2СО2 + 2Н2О.
Дата добавления: 2015-04-21; просмотров: 536; Мы поможем в написании вашей работы!; Нарушение авторских прав |