
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Вопрос 24
Понятие о растворах. Классификация растворов. Жидкие растворы. Межмолекулярное взаимодействие при растворении ионного (NaCl) и слабополярного (CH3COOH) вещества. Сольватация и гидратация ионов. Термодинамические причины образования растворов. Тепловые эффекты при растворении.
Сольватация взаимод. молекул растворенного в-ва (или их ассоциатов) с молекулами р-рителя. Приводит к изменению св-в молекул в р-ре (в сравнении со св-вами газовой фазы), влияет на все физ. и физ.-хим. процессы, протекающие в р-рах, в т. ч. определяет скорость реакций в растворах и положение равновесия, а в ряде случаев и их механизм. С. в водных средах часто наз. гидратацией. Наиб. интенсивна С. ионов врастворах электролитов.С. состоит в том, что молекула растворенного в-ва оказывается окруженной сольватной оболочкой, состоящей из более или менее тесно связанных с ней молекул р-рителя. В результате С. образуются сольваты-мол. образования постоянного или переменного состава. Время жизни соль-ватов определяется характером и интенсивностью межмолекулярных взаимодействий; даже в случае сильного взаимод. время жизни отдельного сольвата мало из-за непрерывного обмена частицами в сольватной оболочке. В соответствии с типами межмол. взаимод. выделяют неспецифическую и специфическую С. Неспецифическая С. обусловлена ван-дер-ваальсовыми взаимод., специфическая С. проявляется гл. обр. вследствие электростатич. взаимод., коор-динац. и водородных связей.Важнейшие термодинамич. характеристики С.-энталь-пия С. DHc и энергия Гиббса С. (своб. энергия С.) DGc, связанные соотношением:DGc= DHc -ТDSc,где DSc -энтропия С., T-абс. т-ра. Энтальпия С. определяет тепловой эффект внедрения молекулы растворенного в-ва в р-ритель; энергия Гиббса С. определяет растворимость в-ва.Наиб. простой способ эксперим. определения энтальпии С. состоит в непосредств. измерении теплового эффекта растворения в-ва А в р-рителе S-энтальпии растворения DH р А/S -и использовании соотношения:
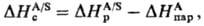 где
где 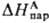
- энтальпия парообразования в-ва А. Благодаря развитию калориметрич. техники определение энтальпий растворения возможно практически для всех систем; осн. проблема состоит в корректном определении энтальпий парообразования. В то же время измерения значений DGc достаточно трудны, особенно в случаях С. ионов в неводных р-рах. Нередко вместо DGc вычисляют изменение этой величины D(DGc) относительно ее значения в водной среде, используя для этого стандартную молярную энергию DG п переноса иона X из воды W в к.-л. р-ритель S:D(DGc) = DG п(X, W:S)= 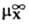 (в р-рителе S)-
(в р-рителе S)- 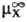 (в воде),где
(в воде),где 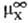 стандартный хим. потенциал иона X (рассматривается бесконечно разб. р-р).
стандартный хим. потенциал иона X (рассматривается бесконечно разб. р-р).
Понятие «гидратация» относится к водным растворам; при других растворителях это явление называют сольватацией. Процесс, обратный гидратации или сольватации, называют соответственно дегидратацией или десольватацией. Гидратация является важным условием растворения веществ и устойчивости их в растворе, в частности стабильности растворов белковых и других биополимеров. Гидратация обусловливает набухание полимеров в водных средах, играет большую роль в проницаемости клеточных мембран, в водно-солевом обмене и так далее.
Особенно склонны к гидратации ионы. Их гидратация обусловлена ориентацией дипольных молекул воды в электрическом поле иона, а гидратация полярных не электролитов — их ориентацией за счет взаимодействия диполей и образования водородных связей.
Упорядоченное расположение молекул растворителя вокруг ионов или полярных групп атомов в молекуле растворенного вещества позволяет говорить об образовании ими гидратных слоев или оболочек. Молекулы воды в гидратном слое остаются химически почти неизменными. Этим гидратация отличается от других химических взаимодействий в растворах, например от гидролиза. Однако в гидратном слое изменяются многие физические свойства воды: давление пара, диэлектрическая проницаемость, сжимаемость, растворяющая способность и другие. Гидратация сопровождается выделением тепла и понижением энтропии растворителя благодаря упорядоченному расположению молекул воды в гидратном слое.
Гидратная оболочка в основном удерживается электростатическими силами притяжения, причем полярные группы могут образовывать с молекулами воды водородные связи. Наиболее прочно связаны с ионами или полярными группами в молекулах растворенного вещества те молекулы воды, которые сосредоточены в первом молекулярном слое; энергия связи у молекул второго слоя значительно ниже; в третьем она уже ничтожно мала.
В результате гидратации ионов часто образуются координационные соединения. Например, гидратация иона Сu2+ в водных растворах происходит так, что четыре молекулы воды распределяются симметрично вокруг Си2+, образуя плоскую фигуру. Гидратированный ион меди Си2+-4Н2О придает раствору характерную голубую окраску. Образование гидратов (сольватов) лежит в основе теории растворов Д. И. Менделеева.
Наиболее прочно связанная гидратная вода может при кристаллизации растворенного вещества из растворов входить в состав его кристаллов (кристаллизационная вода), образуя кристаллогидраты, например CuSО4-5H2О, которые по существу являются комплексными соединениями.
Степень гидратации различных ионов и молекул неодинакова и зависит от размеров частиц и величины их заряда. Чем больше заряд и меньше размеры иона, то есть выше удельная плотность заряда, тем больше степень гидратации. Ион L+ гидратирован больше, так как удельная плотность заряда у него выше, чем у ионов К+. Недиссоциированные молекулы также в той или иной степени гидратированы, их гидратная оболочка возникает только вокруг полярных групп и потому может быть не сплошной.
Гидратация ионов в растворе влияет на их подвижность, причем зависимость обратно пропорциональная.
Раствор- гомогенная (однородная)смесь,образованная не менее чем двумя компонентами,один из которых называется растворителем,а др растворимым веществом,это также система переменного состава,находящаяся в состоянии химического равновесия.
Хим раствор- это смесь одной или нескольких кислот с водой. Раствор – однофазная система перенного состава, состоящая из двух или более компонентов. Растворы –гомогенные (однородные) системы,т е каждый из компонентов распределён в массе другого в виде молекул,атомов или ионов. Растворитель – компонент,агрегатное состояние которого не изменяется при образовании раствора. В случае же раствов,образующихся при смешении газа с газом,жидкости с жидкость,твёрдого вещества с твёрдым,растворителем считается коммпонет,количество которого в растворе преобладает.
Дата добавления: 2015-04-18; просмотров: 262; Мы поможем в написании вашей работы!; Нарушение авторских прав |