
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Способы выражения концентрации растворов (массовая доля, молярная доля, титр, молярная концентрация, нормальная концетрация).
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах.
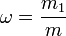
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.

где:
νi — количество i-го компонента, моль;
n — число компонентов;
Титр раствора — масса растворённого вещества в 1 мл раствора.

где:
m1 — масса растворённого вещества, г;
V — общий объём раствора, мл
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
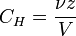
где:
ν — количество растворённого вещества, моль;
V — общий объём раствора, л;
z — число эквивалентов
Молярная концентрация – это отношение количества растворённого вещества к объёму раствора. Она выражается в моль/л и показывает, сколько молей растворённого вещества содержится в 1 л раствора.
Дата добавления: 2015-04-18; просмотров: 239; Мы поможем в написании вашей работы!; Нарушение авторских прав |