
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Вопрос 27. Идеальный раствор. Коллигитивные свойства растворов
Идеальный раствор. Коллигитивные свойства растворов. Понижение давление пара растворителя над раствором, повышение температуры кипения и понижения температуры замерзания раствора (закон Рауля), соматическое давление.
Идеальным раствором называют раствор, для которого выполняется первый закон Рауля.
Идеальными при любых концентрациях являются растворы, компоненты которых близки по физическим и химическим свойствам и образование которых не сопровождается объёмными и тепловыми эффектами. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором.
Коллигативные свойства растворов —— это те их свойства, которые при данных условиях оказываются равными и независимыми от химической природы растворённого вещества; свойства растворов, которые зависят лишь от количества кинетических единиц и от их теплового движения.
Первый закон Рауля связывает давление насыщенного пара над раствором с его составом; он формулируется следующим образом:
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.

Для бинарного раствора, состоящего из компонентов А и В (компонент А считаем растворителем) удобнее использовать другую формулировку:
Относительное понижение парциального давления пара растворителя над раствором не зависит от природы растворённого вещества и равно его мольной доле в растворе.

Понижение температуры кристаллизации растворов
Условием кристаллизации является равенство давления насыщенного пара растворителя над раствором давлению пара над твёрдым растворителем. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, это равенство всегда будет достигаться при температуре более низкой, чем температура замерзания растворителя. Так, океанская вода начинает замерзать при температуре около минус 2 °C.
Разность между температурой кристаллизации растворителя T°fr и температурой начала кристаллизации раствора Tfr есть понижение температуры кристаллизации.
Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрациираствора.

Поскольку по мере кристаллизации растворителя из раствора концентрация последнего возрастает, растворы не имеют определённой температуры замерзания и кристаллизуются в некотором интервале температур.
РАУЛЯ ЗАКОН: относит. понижение парциального давления пара растворитсля над разб. бинарным раствором неэлектролита равно молярной доле растворенного вещества xв:
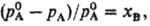
где рА-парциальное давление растворителя,  -давление на-сыщ. пара чистого растворителя. Соотв. для молярной доли растворителя xA можно записать:
-давление на-сыщ. пара чистого растворителя. Соотв. для молярной доли растворителя xA можно записать:

Если пар над раствором нельзя считать идеальным газом. давления  и рА заменяют на фугитивности fА и
и рА заменяют на фугитивности fА и  :
:
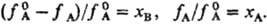
Осмотическое давление. Самопроизвольный переход растворителя через полупроницаемую мембрану,разделяющую раствор и растворитель или два раствора с различной концентрацией растворённого вещества,называется осмосом.
Осмотическое давление, диффузное давление, термодинамический параметр, характеризующий стремление раствора к понижению концентрации при соприкосновении с чистым растворителем вследствие встречной диффузии молекул растворённого вещества и растворителя. Если раствор отделен от чистого растворителя полупроницаемой мембраной, то возможна, лишь односторонняя диффузия — осмотическое всасывание растворителя через мембрану в раствор.
Идеальный раствор. Коллигативные свойства растворов. Понижение давления пара растворителя над раствором, повышение температуры кипения и понижение температуры замерзания раствора (закон Рауля), осмотическое давление.
Идеальный раствор – раствор, между компонентами которого не происходят химические взаимодействия, а силы межмолекулярных взаимодействий между всеми компонентами раствора одинаковы. Теплота образования идеального раствора равна нулю, при его образовании не происходит изменения объёма. Близки по свойствам к идеальным очень разбавленные растворы.
Закон Рауля: относительное понижение давления пара над раствором равно молярной доле растворенного вещества:
Где  - парциальное давление пара над раствором и над чистым растворителем,
- парциальное давление пара над раствором и над чистым растворителем,  - количество растворённого вещества, - количество вещества растворителя.
- количество растворённого вещества, - количество вещества растворителя.
1-ое следствие из закона Рауля: растворы кипят при более высокой температуре, чем соответствующие чистые растворители, и повышение температуры кипения растворов прямо пропорционально моляльной концентрации растворённого вещества:
Для воды она равна 0,512 К*кг/моль
2-ое следствие из закона Рауля: растворы замерзают при более низкой температуре, чем соответствующие чистые растворители, и понижение температуры замерзания растворов прямо пропорционально моляльной концентрации растворённого вещества
Для воды она равна 1,85 К*кг/моль
Давление обеспечивающее осмос, называется осмотическим давлением. Осмос – это процесс самопроизвольной односторонней диффузии растворителя к раствору через полупроницаемую перегородку.
Дата добавления: 2015-04-18; просмотров: 342; Мы поможем в написании вашей работы!; Нарушение авторских прав |