
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Основные законы и формулы
1.Уравнение состояния идеального газа (уравнение Менделеева-
Клапейрона)

где p, V – давление и объём, занимаемый данной массой газа; m,  – масса и молярная масса газа; R – универсальная газовая постоянная;
– масса и молярная масса газа; R – универсальная газовая постоянная;
T – термодинамическая температура  К; t – температура по шкале Цельсия;
К; t – температура по шкале Цельсия;  – количество вещества.
– количество вещества.
2. Для смеси газов справедлив закон Дальтона

где  – парциальное давление
– парциальное давление  компонента смеси; k – число компонентов смеси.
компонента смеси; k – число компонентов смеси.
3.Основное уравнение молекулярно-кинетической теории газов
 или
или 
где  – масса одной молекулы; n – концентрация молекул;
– масса одной молекулы; n – концентрация молекул;  – средняя квадратичная скорость молекул;
– средняя квадратичная скорость молекул;  – средняя кинетическая энергия поступательного движения молекул.
– средняя кинетическая энергия поступательного движения молекул.
4. Средняя кинетическая энергия молекулы (с учётом поступательного и вращательного движений)

где i – число степеней свободы (для одноатомной молекулы i=3(пост.); для двухатомной молекулы i=5 (3 пост. + 2 вращ.); для трех- и более атомной молекулы i=6 (3 пост.+ 3 пост.)); k – постоянная Больцмана.
5. Скорость молекул:
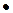 средняя квадратичная
средняя квадратичная


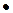 средняя арифметическая
средняя арифметическая

 ,
,
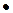 наиболее вероятная
наиболее вероятная
 ;
;  .
.
6. Зависимость давления газа от концентрации молекул и температуры

7. Теплоёмкость системы (тела)
 ,
,
где  – количество теплоты, сообщённое системе (телу);
– количество теплоты, сообщённое системе (телу);  – изменение температуры системы (тела), вызванное сообщением этого количества теплоты.
– изменение температуры системы (тела), вызванное сообщением этого количества теплоты.
8. Молярная и удельная теплоёмкости
 ;
; 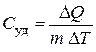 .
.
9. Молярные теплоёмкости идеального газа при постоянном объёме  и постоянном давлении
и постоянном давлении 
 ;
;  .
.
10. Соотношение между молярной и удельной теплоёмкостями

11. Удельные теплоёмкости при постоянном объёме  и постоянном давлении СP уд
и постоянном давлении СP уд
СV уд  ; СР уд
; СР уд 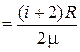 .
.
12. Отношение теплоёмкостей (показатель адиабаты)

13. Внутренняя энергия идеального газа массой m при температуре Т

14. Первое начало термодинамики

где Q – количество теплоты, сообщённое газу в рассматриваемом процессе;  – изменение внутренней энергии в данном процессе;
– изменение внутренней энергии в данном процессе;
А – работа газа над внешними силами.
15. Работа, совершаемая газом, при изменении его объёма

где  и
и  – начальный и конечный объём соответственно.
– начальный и конечный объём соответственно.
16. Для любого процесса, происходящего с идеальным газом, изменение внутренней энергии рассчитывается по одной и той же формуле
 .
.
17. Количество теплоты и работа, совершаемая газом, зависит от вида процесса.
• Изотермический процесс: T= const;  = 0;
= 0;  ;
;
 .
.
• Изохорический процесс: V= const;  ;
;  ;
;
 .
.
• Изобарический процесс Р = const;
 ,
, 
• Адиабатный процесс – процесс, при котором отсутствует теплообмен между системой и окружающей средой:
Q адиаб = 0,
А адиаб = 
или
 А адиаб =
А адиаб =  ,
,
где γ– показатель адиабаты.
18. В адиабатном процессе изменяются все параметры идеального газа: P,V и T. Уравнения адиабатного процесса имеют вид уравнений Пуассона
 ;
;
 ;
;
 .
.
19. КПД тепловой машины:
• любой

• идеальной, работающей по циклу Карно

где А – полезная работа; 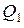 и
и  – соответственно количество теплоты, полученное от нагревателя и отданное холодильнику;
– соответственно количество теплоты, полученное от нагревателя и отданное холодильнику;  и
и  – соответственно температуры нагревателя и холодильника.
– соответственно температуры нагревателя и холодильника.
20. Средняя длина свободного пробега молекул газа

где d – эффективный диаметр молекулы; n – концентрация молекул в единице объёма.
21. Закон Фика для диффузии

где  m – масса вещества, диффундирующей через площадку S, перпендикулярную оси X, за время
m – масса вещества, диффундирующей через площадку S, перпендикулярную оси X, за время  t при градиенте плотности
t при градиенте плотности  ;
;
D – коэффициент диффузии вещества.
22. Сила внутреннего трения

где F – сила внутреннего трения между движущимися слоями газа или жидкости;  – градиент скорости течения слоёв, в направлении перпендикулярном течению слоёв;
– градиент скорости течения слоёв, в направлении перпендикулярном течению слоёв;  – динамическая вязкость (коэффициент внутреннего трения).
– динамическая вязкость (коэффициент внутреннего трения).
23. Закон Фурье для теплопроводности

где ΔQ – количество теплоты, переносимой через площадку S, перпендикулярную оси X, за время Δt при градиенте температуры  ;
;
λ – коэффициент теплопроводности.
24. Коэффициенты явлений переноса для газа:
а) диффузии
 ,
,
б) динамической вязкости
 ,
,
в) теплопроводности
 ,
,
где  – плотность газа;
– плотность газа;  – удельная теплоёмкость газа при постоянном объёме,
– удельная теплоёмкость газа при постоянном объёме,
Дата добавления: 2015-02-10; просмотров: 223; Мы поможем в написании вашей работы!; Нарушение авторских прав |