
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Определение нитратов и нитритов в воде
Предельно допустимая концентрация (ПДК) нитритов (NO2–) в питьевой воде водоемов 3,3 мг/л, нитратов (NO3–) - 45 мг/л.
Качественное определение нитратов и нитритов. На часовое или предметное стекло поместите 3 капли раствора дифениламина, приготовленного на концентрированной серной кислоте (Осторожно!),и 1-2 капли исследуемой воды. В присутствии нитрат- и нитрит-ионов появляется синее окрашивание, интенсивность которого зависит от их концентрации.
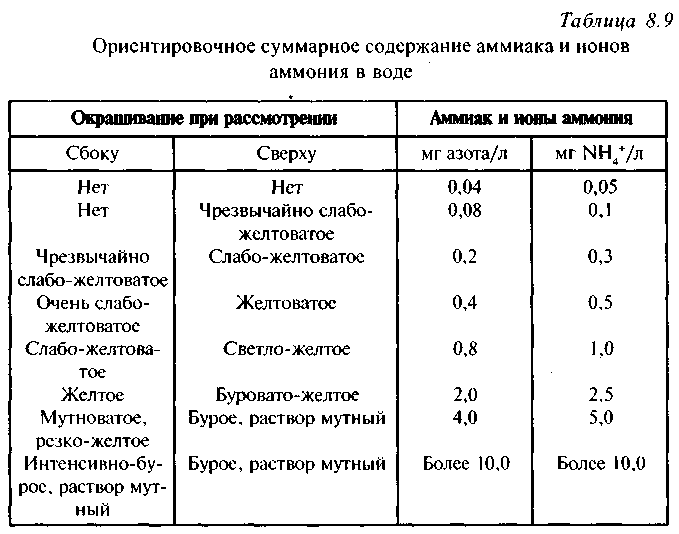
Раздельное определение нитратов и нитритов следует начинать с обнаружения нитритов, которые мешают определению нитратов.
Определение нитритов. К 5 мл исследуемой воды прибавить 0,5 мл реактива Грисса (Осторожно! Реактив содержит вредные вещества. Работать в вытяжном шкафу, используя пипетку с грушей) и нагреть до 70-80° С на водяной бане (в качестве бани можно использовать химический стакан на электроплитке). Появление розового окрашивания той или иной интенсивности свидетельствует о наличии нитрит-ионов в пробе.
 Определение нитратов. Если в воде были обнаружены нитриты, то их предварительно нужно удалить. Для этого в пробирку берут 5 мл анализируемой воды, прибавляют несколько кристалликов хлорида аммония и нагревают над газовой горелкой в течение 10-15 минут.
Определение нитратов. Если в воде были обнаружены нитриты, то их предварительно нужно удалить. Для этого в пробирку берут 5 мл анализируемой воды, прибавляют несколько кристалликов хлорида аммония и нагревают над газовой горелкой в течение 10-15 минут.
После этого присутствие нитратов можно определить раствором дифениламина, как описано выше, либо следующим способом.
К 3 мл исследуемого раствора прилить 2 мл 20%-ного раствора щелочи, добавить 10-15 мг цинковой пыли, смесь осторожно нагреть (можно на водяной бане). Нитраты восстанавливаются до аммиака, который обнаруживается по покраснению фенолфталеиновой бумаги или по посинению красной лакмусовой, смоченной дистиллированной водой и внесенной в пары исследуемого раствора.
Качественное определение нитрит-ионов с приближенной количественной оценкой. В пробирку диаметром 13-14 мм наливают 10 мл исследуемой воды, прибавляют 1 мл реактива Грисса (ТБ!) и нагревают до 70-80° С на водяной бане. Через 10 мин. появившуюся окраску сравнивают со шкалой (табл. 8.10).

Количественное определение нитритов. Для приготовления шкалы готовят основной стандартный раствор (0,15 г нитрита натрия растворяют в 100 мл дистиллированной воды), содержащий 1 мг нитрит-ионов в мл раствора; рабочий раствор готовят разбавлением основного раствора в 1000 раз. С целью повышения точности эту операцию целесообразно выполнить в два приема - сначала разбавить раствор в 50 раз, а затем еще в 20 раз. Для этого 2 мл основного стандартного раствора переносят пипеткой в мерную колбу на 100 мл, доводят объем до метки дистиллированной водой, перемешивают. Затем из полученного раствора берут 5 мл в другую мерную колбу на 100 мл, так же доводят объем до метки и перемешивают. 1 мл полученного раствора содержит 1 мкг нитрит-ионов. В 10 мерных колб на 50 мл вносят рабочий раствор в соответствии с табл. 8.11 и доводят объем до метки дистиллированной водой.

Из каждой колбы взять по 5 мл раствора в 10 пронумерованных пробирок, в 11-ю - 5 мл исследуемой воды, добавить в каждую по 0,5 мл реактива Грисса (ТБ!), перемешать и нагреть на водяной бане при 50-60°С. Через 10-15 минут интенсивность появившейся розовой окраски пробы сравнить со шкалой стандартных растворов.
Количественное определение суммарного содержания нитратов и нитритов. Определение проводят с реактивом Грисса (ТБ!) по вышеописанной методике, предварительно переведя нитраты в нитриты цинковой пылью в кислой среде при рН=3. Для перевода нитратов в нитриты к 10 мл исследуемой воды прибавляют 10-15 мг цинковой пыли и добавляют по каплям 0,1 н. раствор серной кислоты, доводя рН до 3, контролируя его значение по универсальной индикаторной бумаге. Через 10-15 минут отобрать пипеткой 5 мл прозрачного раствора в пробирку и провести анализ.
Количественное определение нитратов. В фарфоровую чашку помещают 10 мл исследуемой воды, прибавляют 1 мл 0,5% раствора салицилата натрия или салициловой кислоты и выпаривают досуха на водяной бане. После охлаждения сухой остаток увлажняют 1 мл концентрированной серной кислоты, тщательно растирают стеклянной палочкой и оставляют на 10 мин. Затем добавляют 5-10 мл дистиллированной воды и количественно переносят в мерную колбу на 50 мл, прибавляют 7 мл 10М гидроксида натрия (Осторожно!), доводят объем дистиллированной водой до метки и перемешивают.
5 мл раствора наливают в пробирку и сравнивают его окраску с контрольной шкалой. За результат анализа следует принимать значение концентрации нитрат-анионов (в мг/л) того образца шкалы, который более всего соответствует окраске полученного раствора.
Если в лаборатории имеется фотоколориметр, раствор помещают в кювету, измеряют его оптическую плотность, значение концентрации нитрат-анионов определяют по предварительно построенному градуировочному графику.
Если окраска содержимого пробирки окажется интенсивнее крайнего образца шкалы (5 мг/л) или значение оптической плотности выходит за пределы градуировочного графика, анализируемую воду разбавляют в 5 раз дистиллированной водой и определение повторяют. При вычислении результатов учитывают степень разбавления пробы.
Для приготовления шкалы готовят основной стандартный раствор, растворяя дистиллированной водой 0,032 г нитрата калия в мерной колбе на 200 мл (0,1 мг нитратов/мл), и рабочий раствор разведением основного в 10 раз (0,01 мг/мл). Затем в фарфоровые чашки вносят 0,1, 2, 5, 10, 15,20 и 25 мл рабочего раствора (что соответствует содержанию нитратов 0; 0,2; 0,4; 1,0; 2,0; 3,0; 4,0 и 5,0 мг/л), добавляют по 1 мл раствора салицилата натрия, выпаривают досуха. Далее проводят те же операции, что и с исследуемой пробой.
Определение нитратов и нитритов в воде по методу АЛ.Рычкова.
Для определения нитратов и нитритов по этому методу необходимы следующие медицинские препараты (их можно приобрести в аптеке): риванол (этакридина лактат), антипирин, оксафенамид, стрептоцид, гидрокарбонат натрия (питьевая сода), физиологический раствор (0,9% раствор хлорида натрия в дистиллированной воде), а также соляная кислота и дихромат калия.
В питьевой воде должно содержаться не более 3,3 мг/л нитрит- и 45 мг/л нитрат-ионов.
Определение нитритов. Для контроля нитритов можно воспользоваться одним из трех методов, пределы обнаружения у которых составляют 1,3; 1,6 и 2 мг/л нитрит-ионов.
Риванольная реакция. К 1 мл исследуемой воды прибавляют 1 мл физиологического раствора и смешивают с 1 мл риванольного раствора (таблетку растворяют при нагревании в 200 мл 8%-ной соляной кислоты). Если появится бледная розовая окраска, значит, уровень нитритов в питьевой воде недопустим.
Антипириновая реакция. 1 мл питьевой воды смешивают с 1 мл физиологического раствора (концентрация нитритов при таком разведении падает вдвое), 1 мл раствора антипирина (одна таблетка в 50 мл 8%-ной соляной кислоты) и быстро прибавляют две капли 1%-ного раствора дихромата калия. Смесь нагревают до появления признаков кипения. Если в течение 5 мин. раствор становится бледно-розовым, то значит, что в нем содержится более 1,6 мг/л нитрит-ионов, а в пробе питьевой воды соответственно вдвое больше (выше 3,2 мг/л). В этом случае содержание нитрит-ионов превышает предельно допустимую концентрацию.
Домашняя модификация метода Грисса. Метод Грисса довольно трудоемок, но этот метод санитарно-гигиенического контроля можно вполне повторить на кухне, не используя быстроокисляющиеся реактивы и специальную аппаратуру
К 1 мл солянокислого раствора стрептоцида (таблетка 0,5 г в 50 мл 8%-ной соляной кислоты) прибавляют 1 мл анализируемой воды, предварительно разбавленной вдвое дистиллированной водой или физраствором, и ставят на 2 мин. в холодильник. Затем в смесь понемногу присыпают гидрокарбонат натрия, пока не перестанут выделяться пузырьки газа. Здесь главное не переборщить с содой, так как ее избыток мешает цветной реакции. Поэтому следует добавлять ее по крупинкам. После того, как кислота нейтрализована, остается прибавить 1 мл холодного раствора оксафенамида в 10%-ный раствор гидрокарбоната натрия (в 100 мл физраствора растворяют 20 таблеток по 0,5 г гидрокарбоната натрия и 1 таблетку оксафенамида). Если в течение 5 мин. смесь приобретает бледно-желтую окраску, вода не пригодна к употреблению.
Определение нитратов (риванольная реакция). К 1 мл исследуемой воды прибавляют 2,2 мл физиологического раствора. Затем отбирают 2 мл приготовленного раствора, добавляют 1 мл солянокислого раствора риванола и немного порошка цинка (на кончике ножа). Если в течение 3-5 мин. желтая окраска риванола исчезнет и раствор окрасится в бледно-розовый цвет, то содержание нитратов в питьевой воде превышает ПДК.
8.2.3.7. Хлориды [37, 38]
Концентрация хлоридов в водоемах-источниках водоснабжения допускается до 350 мг/л.
В поверхностных водах количество хлоридов зависит от характера пород, слагающих бассейны, и варьирует в значительных пределах - от десятых долей до тысячи миллиграммов на литр. В реках северной части России хлоридов обычно немного, не более 10 мг/л, в южных районах эта величина повышается до десятков и сотен мг/л. Много хлоридов попадает в водоемы со сбросами хозяйственно-бытовых и промышленных сточных вод. Этот показатель весьма важен при оценке санитарного состояния водоема.
Качественное определение с приближенной количественной оценкой. В пробирку отбирают 5 мл исследуемой воды и добавляют 3 капли 10%-ного раствора нитрата серебра. Приблизительное содержание хлоридов определяют по осадку или помутнению (табл. 8.12).

Количественное определение хлоридов. Хлориды определяют титрованием пробы анализируемой воды нитратом серебра в присутствии хромата калия как индикатора. Нитрат серебра дает с хлорид-ионами белый осадок, а с хроматом калия - кирпично-красный осадок хромата серебра. Из образовавшихся осадков меньшей растворимостью обладает хлорид серебра. Поэтому лишь после того, как хлорид-ионы будут связаны, начинается образование красного хромата серебра. Появление слабо-оранжевой окраски свидетельствует о конце реакции. Титрование можно проводить в нейтральной или слабощелочной среде. Кислую анализируемую воду нейтрализуют гидрокарбонатом натрия.
В коническую колбу помещают 100 мл исследуемой воды, прибавляют 1 мл 5%-ного раствора хромата калия и титруют 0,05 н. раствором нитрата серебра при постоянном взбалтывании до появления слабо-красного окрашивания.
Содержание хлоридов (X) в мг/л вычисляют по формуле:

где 1,773 - масса хлорид-ионов (мг), эквивалентная 1 мл точно 0,05 н. раствора нитрата серебра;
V - объем раствора нитрата серебра, затраченного на титрование, мл. Техника безопасности! После работы обязательно вымыть руки.
8.2.3.8. Сульфаты [37, 38]
 Концентрация сульфатов в воде водоемов-источников водоснабжения допускается до 500 мг/л.
Концентрация сульфатов в воде водоемов-источников водоснабжения допускается до 500 мг/л.
Содержание сульфатов в природных, поверхностных и подземных водах обусловлено выщелачиванием горных пород, биохимическими процессами и др. В северных водоемах сульфатов обычно не много; в южных районах, где воды более минерализованы, содержание содержание сульфатов увеличивается. Сульфаты попадают в водоемы также со сбросами сточных вод.
Качественное определение с приближенной количественной оценкой. В пробирку вносят 10 мл исследуемой воды, 0,5 мл раствора соляной кислоты (1:5) и 2 мл 5%-ного раствора хлорида бария, перемешивают. По характеру выпавшего осадка определяют ориентировочное содержание сульфатов: при отсутствии мути - концентрация сульфат-ионов менее 5 мг/л; при слабой мути, появляющейся не сразу, а через несколько мин.. -5-10 мг/л; при слабой мути, появляющейся сразу после добавления хлорида бария, - 10-100 мг/л; сильная, быстро оседающая муть свидетельствует о достаточно высоком содержании сульфат-ионов (более 100 мг/л).
Дата добавления: 2015-04-11; просмотров: 3035; Мы поможем в написании вашей работы!; Нарушение авторских прав |