
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Дополнительные методы. Вкус и привкус воды, обнаруживаемые непосредственно в воде (или для водоемов хозяйственно-питьевого назначения после хлорирования)
8.2.4.1. Вкус и привкус воды [37]
Вкус и привкус воды, обнаруживаемые непосредственно в воде (или для водоемов хозяйственно-питьевого назначения после хлорирования), не должны превышать 2 баллов.
Вкус и привкусы оценивают как качественно, так и количественно по интенсивности в баллах. Различают четыре вида вкуса: соленый, горький, сладкий и кислый. Остальные вкусовые ощущения называют привкусами: хлорный, рыбный, металлический и т.п. Интенсивность вкуса и привкуса определяют по 5-балльной шкале так же, как и запах.
Вкус и привкус определяют в сырой воде при комнатной температуре и 60°С. В воде открытых водоемов и источников сомнительных в санитарном отношении вкус воды устанавливают только после ее кипячения.
При исследовании в рот набирают 10-15 мл воды, держат несколько минут (не проглатывать!) и определяют характер и интенсивность привкуса.
8.2.4.2. Осадок [37]
Осадок характеризуют по следующим параметрам: нет, незначительный, заметный, большой. При очень большом осадке указывают толщину слоя в мм. По качеству осадок определяют как хлопьевидный, илистый, песчаный и т.п. с указанием цвета - серый, бурый, черный и др. Осадок в воде водоемов отмечают через 1 ч. после взбалтывания пробы, в воде подземных источников - через 24 ч.
В период выпадения осадка качественно описывают осветление - незаметное, слабое, сильное, вода прозрачна.
8.2.4.3. Щелочность [37]
Под щелочностью понимают способность некоторых компонентов, содержащихся в воде, связывать эквивалентное количество сильной кислоты. Щелочность создают все катионы, которые в воде были уравновешены гидроксид-ионами, анионами слабых кислот (например, карбонаты, гидрокарбонаты). Щелочность определяется количеством сильной кислоты, необходимой для замещения этих ионов. Расход кислоты эквивалентен их общему содержанию в воде и выражает общую щелочность воды.
В обычных природных водах щелочность зависит в основном от присутствия гидрокарбонатов щелочноземельных металлов, в меньшей степени щелочных. В этом случае значение рН воды не превышает 8,3. Растворимые карбонаты и гидрокарбонаты повышают значение рН более 8,3.
Титриметрическое определение щелочности основано на титровании воды сильной кислотой. Количество раствора, необходимое для достижения рН 8,3, эквивалентно свободной щелочности, а для достижения рН 4,5 - общей щелочности. При рН меньше 4,5 ее щелочность равна нулю.
Конечную точку при титровании находят визуально. Щелочность, особенно свободную, следует определять не позднее чем через 24 ч. после отбора пробы. Результаты выражают в ммолях эквивалентов на 1 л, что соответствует числу миллилитров 0,1 М раствора соляной кислоты, израсходованной на титрование 100 мл исследуемой воды.
При визуальном определении мешает интенсивная окраска воды. Ее устраняют, прибавляя активированный уголь и фильтруя пробы. Мутные воды фильтруют через бумажный мелкопористый фильтр. Для более точного определения щелочности предварительно вытесняют свободный углекислый газ, продувая воздух, так как высокие концентрации диоксида углерода мешают обнаружить переход окраски при титровании.
Для анализа потребуется:
1. Раствор соляной кислоты (0,1 M), который можно приготовить не из фиксанала, а из приблизительной концентрации с последующим определением поправочного коэффициента к 0,1 М раствору НС1 по карбонату натрия. Поправочный коэффициент К рассчитывают по формуле:

где V - объем 0,1 н. раствора соляной кислоты, израсходованной на титрование 20 мл 0,1 н. раствора карбоната натрия.
2. Фенолфталеин, 0,5% раствор. В 50 мл 96%-ного этилового спирта растворяют 0.5 г фенолфталеина и разбавляют 50 мл дистиллированной воды, добавляют по каплям 0,01 М раствор гидроксида натрия до появления заметной розовой окраски.
3. Метиловый оранжевый, 0,05% водный раствор.
Свободная щелочность. Ход определения. Отмеряют 100 мл исследуемой воды (при высокой щелочности берут меньший объем и разбавляют до 100 мл прокипяченной и охлажденной дистиллированной водой), прибавляют 2 капли 0,5% фенолфталеина и титруют на белом фоне 0,1 М раствором соляной кислоты до полного обесцвечивания.
Общая щелочность. Отмеривают 100 мл пробы, прибавляют 2 капли метилоранжа, затем продувают воздух в течение 2-3 мин. и титруют 0,1 М раствором соляной кислоты на белом фоне до начала перехода окраски метилового оранжевого из желтой в оранжевую. Вновь продувают воздух 2-3 мин., и если возвращается первоначальная окраска, то дотитровывают. Титрование считают законченным, если после продувания воздуха окраска раствора не меняется.
Расчет свободной (С) и общей (Об) щелочности (ммоль эквивалентов в литре) производят по формулам:

где А - объем 0,1 М раствора соляной кислоты, израсходованной на титрование по фенолфталеину, мл;
К - поправочный коэффициент к 0,1 М раствору НСl;
V - объем пробы воды, взятый для анализа, мл.
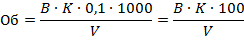
где В - объем 0,1 М раствора соляной кислоты, израсходованной на титрование по метиловому оранжевому, мл;
К - поправочный коэффициент к 0,1 М раствору НСl;
V - объем пробы воды, взятый для анализа, мл.
Общая и свободная щелочность находятся в зависимости от количественного соотношения гидрокарбонат-, карбонат- и гидроксид-ионов. По величине свободной и общей щелочности можно косвенно вычислить количество этих ионов.
Расчет основан на предположении, что щелочность вызывается в основном ионными формами диоксида углерода и в меньшей степени гидроксид-ионами. Расчет дает приблизительные результаты. В зависимости от соотношения свободной (С) и общей (Об) щелочности возможны следующие случаи расчета.
Величина свободной щелочности равна концентрации карбонат-ионов (ммоль-экв./л). Умножая значение свободной щелочности на 30 (эквивалент карбонат-иона), получаем содержание карбонат-ионов (мг/л).
Величина общей щелочности равна величине концентрации гидрокарбонат-ионов (ммоль-экв./л). Умножая значение общей щелочности на 61 (эквивалент гидрокарбонат-иона), получаем содержание гидрокарбонат-ионов (мг/л) (табл.8.15).

8.2.4.4. Кислотность[37, 38]
Кислотностью называется содержание в воде веществ, вступающих в реакцию с гидроксид-ионами. Расход гидроксида выражает общую кислотность воды. В обычных природных водах кислотность в большинстве случаев зависит только от содержания свободного углекислого газа. Естественную часть кислотности создают также гуминовые и другие слабые органические кислоты. В этих случаях рН воды не бывает ниже 4,5.
В загрязненных водоемах может содержаться большое количество сильных кислот или солей за счет сброса промышленных сточных вод. В этих случаях рН может быть ниже 4,5. Часть общей кислотности, снижающей рН ниже 4,5, называется свободной.
Кислотность воды определяют титрованием раствором сильной щелочи. Количество титрованного раствора, израсходованного до получения рН 4,5, соответствует свободной кислотности; количество же, израсходованное до получения рН 8,3, - общей. Если рН > 8,3, то се кислотность равна 0. Для определения кислотности воду титруют 0,1 М раствором NaOH. Конец титрования определяют визуально. Кислотность выражают в ммоль эквивалентов на 1 л. Определению мешает свободный хлор. Его устраняют добавлением тиосульфата натрия.
Свободная кислотность. Она определяется, если рН пробы < 4,5 (кислая реакция по метиловому оранжевому), т.е. проба содержит свободную кислоту. К 100 мл пробы добавляют 2 капли раствора метилового оранжевого и титруют на белом фоне 0,1 н. раствором NaOH до появления желтой окраски индикатора.
В загрязненных водоемах может содержаться большое количество сильных кислот или солей за счет сброса промышленных сточных вод. В этих случаях рН может быть ниже 4,5. Часть общей кислотности, снижающей рН ниже 4,5, называется свободной.
Кислотность воды определяют титрованием раствором сильной щелочи. Количество титрованного раствора, израсходованного до получения рН 4,5, соответствует свободной кислотности; количество же, израсходованное до получения рН 8,3, - общей. Если рН > 8,3, то ее кислотность равна 0. Для определения кислотности воду титруют 0,1 М раствором NaOH. Конец титрования определяют визуально. Кислотность выражают в ммоль эквивалентов на 1 л. Определению мешает свободный хлор. Его устраняют добавлением тиосульфата натрия.
Свободная кислотность. Она определяется, если рН пробы < 4,5 (кислая реакция по метиловому оранжевому), т.е. проба содержит свободную кислоту. К 100 мл пробы добавляют 2 капли раствора метилового оранжевого и титруют на белом фоне 0,1 н. раствором NaOH до появления желтой окраски индикатора.
Общая кислотность. Пробу объемом 100 мл титруют в присутствии 3 капель раствора фенолфталеина 0,1 М раствором едкого натра до появления розовой окраски индикатора, не исчезающей в течение 1 мин.
Расчет свободной (С) и общей (Об) кислотности (ммоль-экв./л) проводят по формулам:
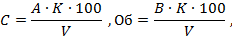
где А - объем 0,1 М раствора NaOH, израсходованного на титрование по метиловому оранжевому, мл;
В - то же по фенолфталеину, мл;
V - объем пробы воды, взятый для определения, мл.
К - поправочный коэффициент к 0,1 М раствору NaOH, определяемый по формуле:

где V - объем 0,1 н. раствора соляной кислоты (из фиксанала), израсходованной на титрование 20 мл 0,1 н. раствора гидроксида натрия, мл.
8.2.4.5. Свинец[37, 40]
Свинец является одним из основных загрязнителей окружающей среды. Он обладает способностью поражать центральную и периферическую нервную систему, костный мозг и кровь, сосуды, генетический аппарат, нарушает синтез белка, вызывает малокровие и параличи. Большая концентрация свинца тормозит биологическую очистку сточных вод. Основными источниками загрязнения свинцом являются выхлопные газы автотранспорта и сточные воды различных производств.
Допустимая концентрация свинца в воде - 0,03 мг/л.
Обнаружение ионов свинца
Качественное определение с родизонатом натрия. На лист фильтровальной бумаги нанести несколько капель исследуемого раствора и добавить 1 каплю свежеприготовленного 0,2% раствора родизоната натрия. В присутствии ионов свинца образуется синее пятно или кольцо. При добавлении 1 капли буферного раствора синий цвет превращается в красный. Реакция очень чувствительна: обнаруживаемый минимум 0,1 мкг.
Количественное определение с дихроматом калия. Дихромат- и хромат-ионы образуют с ионами свинца малорастворимый хромат свинца желтого цвета. 0,5-1 л анализируемой воды упарить до объема 10 мл. К полученной пробе прилить 5 мл раствора азотной кислоты (1:2), нагреть на водяной бане в течение 15 мин., отфильтровать и в фарфоровой чашке выпарить (ТБ!). К сухому остатку прилить 2 мл 0,5% раствора ацетата натрия и 8 мл дистиллированной воды. Раствор перемешать и отфильтровать в пробирку. Подготовить стандартную шкалу (табл. 8.16).

Во все пробирки стандартной шкалы и в пробирку с пробой внести по 1 мл 50%-ного раствора СН3СООН и перемешать. Добавить по 0,5 мл 10%-ного раствора дихромата калия, при наличии в исследуемой пробе ионов свинца выпадает желтый осадок хромата свинца:

Пробирки встряхнуть и через 10 мин. приступить к определению. Содержимое пробирок рассматривать сверху на черном фоне, верхнюю часть пробирок до уровня жидкости прикрыть со стороны света картоном.
Концентрация свинца в анализируемой воде рассчитывается по формуле:
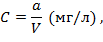
где а - содержание свинца в соответствующей пробирке шкалы, мг;
V - объем взятой на анализ воды, л.
Приготовление растворов
Буферный раствор. 1,9 г гидротартрата натрия NaHC4H4О6 и 1,5 г винной кислоты Н2С4Н4О6 растворить в 100 мл дистиллированной воды.
Раствор дихромата калия. 10 г К2Сr2O7 растворить в 100 мл дистиллированной воды.
Стандартный раствор. 0,032 г Pb(NO3)2 растворить в 200 мл дистиллированной воды (1 мл раствора содержит 0,1 мг свинца).
Дата добавления: 2015-04-11; просмотров: 362; Мы поможем в написании вашей работы!; Нарушение авторских прав |