
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Выполнение анализа в присутствии ионов марганца (II).
К пробе воды, взятой для определения жесткости (100 мл), добавляют 3 капли 1%-ного раствора солянокислого гидроксиламина. При этом происходит маскировка иона марганца. Затем в обычной последовательности прибавляют буферный раствор, индикатор и титруют раствором трилона Б. Точка перехода отчетлива. Расчет выполняют, как и в предыдущих анализах.
При отсутствии набора реактивов для определения жесткости воды определение можно провести спиртово-мыльным методом.
Определение жесткости спиртово-мыльным методом[10]
Сущность этого метода заключается в том, что растворенные в воде соли кальция и магния переводятся содержащимися в мыле стеаратом, олеатом и пальмитатом натрия в малорастворимые кальциевые и магниевые соли. Окончание реакции определяют по появлению устойчивой пены, образуемой избытком мыльного раствора при титровании.
Порядок и техника проведения работы.
1. Подготовить спиртово-мыльный раствор. Для этого 0,75 г детского мыла (в стружках) растворяют в 50 мл 96%-ного спирта-ректификата, отстаивают двое суток и фильтруют через бумажный фильтр средней плотности.
2. Для подготовки эталонного раствора солей кальция и магния необходимо 0,385 г кристаллического хлорида кальция CaCl2 ∙ 6H2О растворить дистиллированной водой в мерной колбе на 50 мл и 0,108 г кристаллического сульфата магния MgSО4 ∙ 7Н2О растворить в 30 мл воды.
В мерную колбу на 100 мл влить 37,5 мл раствора хлорида кальция и весь раствор сульфата магния, перемешать их и долить дистиллированной водой до метки. В полученном таким образом растворе будет содержаться 26,25 ммоль-экв./л ионов кальция и 8,75 ммоль-экв./л ионов магния. Общая жесткость эталонного раствора будет равна 35 ммоль-экв./л.
3. Подготовить таблицу для записи данных опыта (табл. 8.7)

4. Провести титрование эталонных растворов, составить таблицу и калибровочную кривую для данного образца спиртово-мыльного раствора и эталонного раствора солей кальция и магния.
4.1. В чистую мерную колбу емкостью 100 мл налить 1 мл эталонного раствора и долить дистиллированной водой до метки.
4.2. Полученный раствор перелить в склянку с притертой пробкой и осторожно титровать из бюретки спиртово-мыльным раствором, встряхивая содержимое склянки после прибавления каждых двух-трех капель спиртово-мыльного раствора. Титрование прекращают тогда, когда после восьмикратного встряхивания склянки в ней образуется устойчивая пена, не исчезающая в течение 3 мин. Отметить объем израсходованного спиртово-мыльного раствора, затраченного на титрование, и записать в таблицу.
4.3. Отмерить в мерные колбы на 100 мл последовательно 2, 4, 5, 10 и 20 мл эталонного раствора, довести объем каждого раствора до 100 мл и титровать так же, как и первую пробу.
4.4. На основании данных эксперимента начертить эталонный график (калибровочную кривую), откладывая на оси абсцисс значения жесткости эталонных образцов титруемого раствора, на оси ординат - объем затраченного спиртово-мыльного раствора.
5. Для определения жесткости исследуемого раствора берут пробы по 100 мл. Титрование проводят точно так же, как титровали эталонные растворы.
Общую жесткость исследуемого раствора находят по эталонному графику на основании объема спиртово-мыльного раствора, затраченного на титрование. Проводят не менее трех титрований, из них берут среднее значение жесткости.
6. Если общая жесткость раствора окажется выше, чем отражено на графике, то определение следует повторить с разбавлением жесткой воды дистиллированной водой с соблюдением кратности разбавления, чтобы можно было ее учесть при вычислении жесткости.
Определение карбонатной жесткости воды и расчет концентрации карбонат- и гидрокарбонат-ионов. В склянку наливают 10 мл анализируемой воды, добавляют 5-6 капель фенолфталеина. Если при этом окраска не появляется, то считается, что карбонат-ионы в пробе отсутствуют. В случае возникновения розовой окраски пробу титруют 0,05 н. раствором соляной кислоты до обесцвечивания. Концентрацию карбо нат-ионов рассчитывают по формуле:
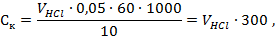
где Ск — концентрация карбонат-иона, мг/л;
VHCl- объем соляной кислоты, израсходованной на титрование, мл.
Затем в той же пробе определяют концентрацию гидрокарбонат-ионов. К пробе добавить 1-2 капли метилового оранжевого. При этом проба приобретает желтую окраску. Раствором 0,05 н. соляной кислоты титруют пробу до перехода желтой окраски в розовую. Концентрацию гидрокарбонат-ионов рассчитывают по формуле:

где Сгк- концентрация гидрокарбонат-иона, мг/л;
VHCl- объем соляной кислоты, израсходованной на титрование, мл. Карбонатную жесткость Жк рассчитывают, суммируя значения концентраций карбонат- и гидрокарбонат-ионов по формуле:
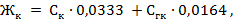
где 0,0333 и 0,0164 - коэффициенты, равные величинам, обратным эквивалентным массам этих анионов.
8.2.3.4. Растворенный кислород[37]
 Концентрация кислорода, растворенного в водоемах санитарного водопользования, в пробе, отобранной до 12 ч. дня, должна быть не менее 4 мг кислорода/л в любой период года.
Концентрация кислорода, растворенного в водоемах санитарного водопользования, в пробе, отобранной до 12 ч. дня, должна быть не менее 4 мг кислорода/л в любой период года.
Количество растворенного кислорода в воде имеет большое значение для оценки состояния водоемов, и его снижение указывает на резкое изменение биологических процессов водоема, а также на загрязнение водоемов веществами, легко биохимически окисляющимися.
Йодометрическое определение растворенного кислорода по Винклеру
Метод основан на способности гидроксида марганца (II) окисляться в щелочной среде до гидроксида марганца (IV). Кислород, растворенный в воде, при этом количественно связывается. При добавлении избытка кислоты из гидроксида марганца (IV) образуется соль двухвалентного марганца. Если вместе с кислотой к осадку гидроксида марганца (IV) добавить йодид калия, то выделяется йод, химически эквивалентный связанному кислороду. Выделившийся йод оттитровывают тиосульфатом натрия. Предел обнаружения растворенного кислорода- 0,05 мг/л.
Определению мешают взвешенные и органические вещества, нитриты, двух- и трехвалентное железо, а также другие окислители и восстановители. Их влияние можно устранить в ходе анализа.
Для определения необходимо приготовить «кислородные» склянки емкостью 100-200 мл с притертой (пришлифованной) пробкой, калиброванные с точностью до 0,1 мл. Калибровку осуществляют взвешиванием. Объем склянки определяют по разности массы склянки, полностью заполненной дистиллированной водой при 20°С и закрытой пробкой, и массы пустой сухой склянки, также закрытой пробкой. Склянки и соответствующие пробки нумеруют.
Реактивы
1. Сульфат или хлорид марганца (II), раствор. Растворяют 40 г MnSO4∙2Н2О, или 48 г MnSО4 ∙ 4Н2О, или 36,4 г MnSО4 ∙ Н2О, или 42,5 г MnCl2 ∙ 4Н2О в дистиллированной воде и доводят объем до 100 мл. Фильтруют через бумажный фильтр или сливают через сифон после полного отстаивания осадка. Разбавленный раствор в кислой среде при добавлении йодида калия не должен выделять свободного йода.
2. Щелочной раствор йодида калия.
а) Растворяют 15 г йодида калия в 10 мл дистиллированной воды. При подкислении разбавленный раствор не должен выделять йода.
б) Растворяют 50 г гидроксида натрия или 70 г гидроксида калия в 50 мл дистиллированной прокипяченной (для удаления углекислого газа) воды (растворение проводят осторожно, небольшими порциями прибавляя гидроксид). Оба раствора смешивают и доводят объем до 100 мл.
3. Соляная кислота, разбавленный 2:1 раствор.
4. Тиосульфат натрия, 0,02 н. раствор.
5. Йод, 0,02 н. раствор в насыщенном растворе NaCl.
6. Йодид калия, 15%-ный раствор.
7. Крахмал, 0,5%-ный раствор.
Ход определения. При взятии пробы на кислород соблюдают все предосторожности против попадания в пробу атмосферного воздуха. Пробу берут в калиброванную склянку на 100-200 мл с притертой пробкой. При взятии пробы следят за тем, чтобы наполнить склянку до краев. Наполнение склянки водой лучше осуществлять с помощью батометра (рис. 8.10).
Кислород фиксируют на месте тотчас после отбора пробы. Для этого в нее вводят опущенной до дна пипеткой 1 мл сульфата или хлорида марганца и 1 мл щелочного раствора йодида калия на каждые 100-150 мл пробы. После введения реактивов закрывают склянку пробкой, следя за тем, чтобы в склянке не осталось пузырьков воздуха. Затем содержимое тщательно перемешивают многократным резким перевертыванием склянки. В таком состоянии пробу можно оставить для транспортировки, но не более чем на сутки.
Перед титрованием (осадок должен хорошо осесть) приливают 5 мл НС1 (2:1), при этом часть жидкости сливается через край, что не имеет значения для определения. Склянку закрывают пробкой (воздуха под пробкой не должно быть) и содержимое тщательно перемешивают. Осадок гидроксида марганца, выпавший в щелочной среде, растворяется, окисляет йодид-ион до йода, который окрашивает раствор в желтый цвет. После этого всю пробу переливают в колбу на 250-300 мл и быстро титруют 0,02н. тиосульфатом натрия при непрерывном помешивании до слабо-желтого цвета, после чего прибавляют 1 мл 0,5% крахмала и продолжают по каплям титровать до исчезновения синей окраски. Окраска должна исчезнуть от одной капли тиосульфата.
Содержание растворенного кислорода в воде (мг кислорода/л) рассчитывают по формуле:

где V - объем раствора тиосульфата, пошедшего на титрование пробы, мл;
Сн - нормальная концентрация тиосульфата с учетом поправки;
8 - эквивалентная масса кислорода, соответствующая 1 мл 1н. раствора тиосульфата;
V1 - объем пробы воды в склянке, мл;
V2 - объем воды, вылившейся при введении реактивов для фиксации кислорода (7 мл).
Определение растворенного кислорода в присутствии мешающих веществ.Если вода содержит много органических веществ или минеральных восстановителей, то необходимо вводить поправку на их йодопотребление. Для этого исследуемую воду отбирают в две склянки одинакового объема и затем пипетками с длинными носиками вносят в каждую по 3-5 мл 0,02н. йода в насыщенном растворе хлорида натрия. Склянки закрывают пробками, перемешивают и через 5 мин. вносят по 1 мл щелочного раствора йодида калия в обе склянки, а затем в склянку «а» - 1 мл соли марганца, в склянку «б» - 1 мл дистиллированной воды. Закрывают пробками и перемешивают. После оседания осадка в обе склянки вносят в одинаковом количестве кислоту и йод оттитровывают тиосульфатом. Содержание растворенного кислорода рассчитывают по формуле:

где V3 - объем 0,02 н. раствора тиосульфата, пошедшего на титрование раствора в склянке «а», мл;
V4 - то же для склянки «б»;
Сн - нормальность раствора тиосульфата с учетом поправки;
8 - эквивалентная масса кислорода, соответствующая 1 мл 1н. раствора тиосульфата;
V1 - объем кислородной склянки, мл;
V2 - объем всех реактивов, внесенных в воду для фиксации кислорода, мл.
8.2.3.5. Окисляемостъ[37]
Окисляемость - общее количество содержащихся в воде восстановителей (неорганических и органических), реагирующих с сильными окислителями (например, дихроматом, перманганатом и др.). Результаты определения окисляемости одной и той же воды с помощью различных окислителей обычно неоднозначны из-за неодинаковой степени окисления веществ, присутствующих в воде. Это зависит от свойств окислителя, его концентрации, температуры, рН воды и т.п. Вместо термина «окисляемость» часто используется термин «потребление кислорода».
Все методы определения окисляемости условны, а получаемые результаты сравнимы только в том случае, когда точно соблюдаются все условия проведения анализа.
Результаты определения окисляемости приводят в миллиграммах кислорода на 1 л воды (мг кислорода/л).
Наиболее полное окисление достигается дихроматом калия, поэтому дихроматную окисляемость нередко называют «химическим потреблением кислорода» (ХПК). Это основной способ определения окисляемости. Большинство соединений окисляется при этом на 95-100%. Нормативы ХПК воды водоемов хозяйственно-питьевого водопользования - 15 мг кислорода/л, культурно-бытового - 30 мг кислорода /л.
Дихроматный метод недоступен для школ из-за отсутствия соответствующих реактивов. Более доступным является перманганатный метод (метод Кубеля). Перманганат как окислитель может окислять как в кислой, так и в щелочной средах. При малом содержании хлоридов окисление ведут в кислой среде при повышенном (более 300 мг/л хлорид-ионов) - в щелочной.
Определение окисляемости в кислой среде. Метод основан на способности перманганата калия окислять различные вещества. Так как степень окисления зависит от условий, при которых ведется определение, для получения достоверных результатов, сравнимых между собой, строго придерживаются приводимых ниже указаний относительно количества добавляемых растворов, времени кипячения и температуры раствора при титровании.
При небольшой окисляемости воды (до 10 мг кислорода/л) для определения достаточно взять 100 мл воды, если же окисляемость испытуемой воды, по предварительным данным, выше 10 мг кислорода/л, воду необходимо разбавить в соответствующее число раз дистиллированной водой. При большой цветности (выше 40°) воду тоже разбавляют дистиллированной водой.
Ход определения. В коническую колбу на 200-250 мл наливают пипеткой 100 мл испытуемой воды. Прибавляют 5 мл раствора серной кислоты (1:3) и ставят на нагревательный прибор. При начале кипения (появление первых пузырьков) в пробу добавляют точно 10 мл 0,01 М раствора перманганата калия. После этого пробу кипятят на малом огне 10 мин.
Для равномерного кипения рекомендуется поместить в колбу несколько стеклянных капилляров, запаянных с одного конца. Колбу при кипячении прикрывают стеклянной воронкой. Если во время кипячения исследуемая вода обесцветилась или потеряла розовую окраску, определение надо повторить, разбавив ее дистиллированной водой.
По окончании кипячения пробу снимают с огня и в нее добавляют из бюретки точно 10 мл 0,01 н. раствора С2Н2O4 (щавелевой кислоты). Обесцветившуюся горячую жидкость дотитровывают 0,01 н. раствором КМnO4 до появления слабо-розового оттенка.
Нормальность раствора КМnO4 проверяют одновременно с анализом. В только что оттитрованную пробу, имеющую температуру около 50-60° С, прибавляют 10 мл 0,01 н. раствора щавелевой кислоты и титруют раствором перманганата калия до появления слабо-розовой окраски. Поправку к титру 0,01 н. раствора КМnO4 определяют из соотношения

где К - поправка на 0,01 н. раствор КМnO4;
10 - объем раствора щавелевой кислоты, мл;
n - объем раствора перманганата калия, мл.
Вычисление результатов. Окисляемость воды определяют по формуле:
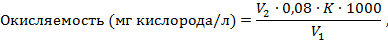
где V1 - объем исследуемой воды, мл;
V2 - объем раствора перманганата калия, израсходованного на титрование избытка щавелевой кислоты, мл;
0,08 - количество кислорода, соответствующее 1 мл 0,01 н. раствора перманганата калия, мг;
К - поправка на 0,01 н. раствора КМnО4.
Определение поправки на дистиллированную воду. При разведении испытуемой воды дистиллированной при подсчете окисляемости вводят поправку на дистиллированную воду. Для этого проводят все определения со 100 мл дистиллированной воды совершенно так же, как и с исследуемой водой. Объем раствора перманганата калия (в мл), пошедший на окисление дистиллированной воды, при расчете окисляемости вычитают из объема раствора КМnO4, израсходованного на окисление пробы.
Формула для расчета следующая:

где все обозначения прежние, а V3 - объем раствора перманганата, пошедшего на окисление дистиллированной воды (мл).
Качественное определение с приближенной количественной оценкой. 5 мл исследуемой воды (предварительно отфильтрованной) прилить в пробирку, добавить 0,3 мл раствора серной кислоты (1:3) и 0,5 мл 0,01 н. раствора перманганата калия. Смесь перемешать, оставить на 20 мин. По цвету раствора оценить величину окисляемости (табл. 8.8).

Биохимическое потребление кислорода (БПК) - это количество кислорода (мг), требуемое для окисления находящихся в 1 л воды органических веществ в аэробных условиях при 20°С в результате протекающих в воде биохимических процессов за определенный период времени (БПК за 3, 5, 10, 20 суток и т. д.). В аналитической практике чаще всего определяют 5-суточное БПК, (установлено, что БПК, составляет 70% БПК полного). Величина полного БПК регламентируется в зависимости от категории водоема: не более 3 мг кислорода/л для водоемов хозяйственно-питьевого водопользования и не более 6 мг кислорода/л для водоемов хозяйственно-бытового и культурного водопользования.
Среди различных методов установления БПК наиболее распространено определение по разности содержания растворенного кислорода до и после инкубации при стандартных условиях (20° С, аэробные условия без дополнительного доступа воздуха и света). В величину БПК не входит расход кислорода на нитрификацию. Для подавления этого процесса в пробу воды можно ввести вещества, ингибирующие нитрифицирующие микроорганизмы и не влияющие на микроорганизмы, осуществляющие основные биохимические процессы (например, этилентиокарбамид), из расчета 1 мл 0,05 % раствора на 1 л исследуемой воды.
Ход определения. Пробу воды для определения БПК обрабатывают в день отбора. Температура исследуемой воды должна быть 20°С, рН в пределах 6,5 - 8,5.
БПК относительно чистых речных вод чаще всего исследуют без разбавления. Для этого исследуемую воду переливают в бутыль, наполнив ее на 2/3 объема, и аэрируют воду в течение 1 минуты путем встряхивания. Затем разливают ее в 6 кислородных склянок до краев. В трех из них фиксируют и определяют количество растворенного кислорода по методике, описанной в разделе 7.2.6. Остальные склянки ставят в термостат с температурой 20° С и через 5 суток в них также определяют растворенный кислород. Величину БПК5 рассчитывают по формуле:
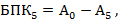
где А0 – А5 - концентрация кислорода в пробе до начала инкубации (нулевой день) и после (через 5 суток), мг кислорода/л.
Для сильнозагрязненных речных и сточных вод, как правило, требуется предварительное разбавление пробы, иначе растворенного кислорода может не хватить для биохимического окисления загрязнений. Разбавленную воду аэрируют, разливают в кислородные склянки и определяют, как указано выше. Параллельно обязательно устанавливают БПК разбавляющей воды. В качестве разбавляющей воды можно использовать дехлорированную (отстоенную) водопроводную воду. В этом случае величину БПК (мг кислорода/л) вычисляют по следующей формуле:

где А0 - концентрация кислорода в пробе до начала инкубации (нулевой день), мг кислорода/л;
В0 - то же в разбавляющей воде, мг кислорода/л;
а5 - концентрация кислорода в пробе в конце инкубации (через 5 дней), мг кислорода/л;
В5 - то же в разбавляющей воде, мг кислорода/л;
n - кратность разбавления.
Приготовление реактивов
1. Раствор КМnO4 0,01 н. готовят, растворяя 0,316 г КМnO4 в 1 л дистиллированной воды. Раствор лучше готовить заблаговременно и хранить в темной склянке. Титр раствора изменчив, и при каждом определении его устанавливают по щавелевой кислоте.
2. Раствор щавелевой кислоты. Для приготовления 0,01 н. раствора щавелевой кислоты берут точно 0,6302 г Н2С2О4 ∙ 2Н2О, высушенной на воздухе, и растворяют в 1 л дистиллированной воды. Для консервации щавелевой кислоты вносят 30 мл раствора серной кислоты (1:3) так, чтобы общий объем раствора щавелевой кислоты был равен 1 л.
8.2.3.6. Аммиак, ионы аммония, нитраты, нитриты [10, 37, 38, 39]
 Определение аммиака и ионов аммония (качественное с приближенной количественной оценкой). Предельно допустимая концентрация (ПДК) аммиака и ионов аммония в воде водоемов 2 мг/л по азоту или 2,6 мг/л в виде иона аммония.
Определение аммиака и ионов аммония (качественное с приближенной количественной оценкой). Предельно допустимая концентрация (ПДК) аммиака и ионов аммония в воде водоемов 2 мг/л по азоту или 2,6 мг/л в виде иона аммония.
Ход определения. Впробирку диаметром 13-14 мм наливают 10 мл исследуемой воды, прибавляют 0,2-0,3 мл 30%-ного раствора сегнетовой соли и 0,2 мл реактива Несслера (Осторожно! Реактив содержит соль ртути и щелочь. Работать в вытяжном шкафу, используя пипетку с грушей).Через 10-15 мин. проводят приближенное определение по табл. 8.9.
Дата добавления: 2015-04-11; просмотров: 463; Мы поможем в написании вашей работы!; Нарушение авторских прав |