
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Жұмыстың мақсаты мен мазмұны
Цинк, кадмий, сынап атомдарының шығару спектрiн зерттеу, осы элемент спектрлерiнiң құрылымын зерттеу, тәжiрибеде триплеттiк жiктелудi анықтау.
6.2. Аппаратура
УМ-2 монохроматоры, сынап лампа (шам), сынап, кадмий, цинк элементтерiнiң ВСБ-2 шамдары, ППБЛ-3 қоректендiру блогы.
6.3. Теориялық кiрiспе
Атомдағы электрон күйi берiлуi үшін төрт кванттық сан қажет.
1. Бас кванттық сан n, негiзiнен электрон энергиясын анықтайды және n=1, 2, 3,... мәндерiн қабылдайды.
2. Орбиталық кванттық сан l, электронның орбиталық импульс моментi мәнiн  теңдiгiне сәйкес анықтайды;
теңдiгiне сәйкес анықтайды;
l=0, 1, 2,...(n-1) -барлығы n мән қабылдайды.
3.
| |
4. Спиндiк кванттық сан s, микробөлшектiң меншiктi (спиндiк) импульс моментiн 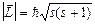 теңдiгiне сәйкес анықтайды. Электрон үшін s=1/2, сондықтан оның спиндiк моментiнiң кквантталу бағытына (z осi) проекциясы тек екi мән қабылдай алады: Lsz=msh, ms=±1/2.
теңдiгiне сәйкес анықтайды. Электрон үшін s=1/2, сондықтан оның спиндiк моментiнiң кквантталу бағытына (z осi) проекциясы тек екi мән қабылдай алады: Lsz=msh, ms=±1/2.
l cанының мәнiне сәйкес атомдағы электрон күйi былай белгiленедi: егер l=0 болса, онда күй s-күй деп аталады (немесе s-электрон), егер l=1 болса, онда бұл р-күй, егер l=2 болса, онда d-күй, және т.т. 2р символына n=2 және l=1, 3s символына n=3 және l=0 сәйкес келедi.
Паули принципiне сәйкес атомдағы электрондар жүйесiнде төрт кванттық сан жиыны бiрдей болатын екi электроннның болуы мүмкін емес. Бұл принцип ең аз энергия принципiмен бiрге электрондардың кванттық күйлер (қабықшалар) бойынша үлестiрiлуiн тағайындайды, және де осы үлестiрiлудi атом қасиеттерiнiң периодтық қасиеттерiмен байланыстырады. Элементтердiң химиялық және оптикалық қасиеттерi оның валенттiк электрон санымен анықталады, сондықтан валенттiк электрон саны бiрдей жүйелердiң спектрлерiнде ұқсастық жеткiлiктi болады. Атомда валенттiк электрондар неғұрлым көп болса, және элементтiң реттiк нөмiрi неғұрлым үлкен болса, соншалықты спектр құрылымы күрделi болады.
Сутегi атомында ядроның кулондық өрiсiнде қозғалатын бiр электрон болады. Осы электронның стационарлық энергия мәндерi (деңгейлерi) тек n бас кванттық сан мәнiне тәуелдi болатындығы кванттық механикада көрсетiледi.
| |
Сiлтiлiк металл атомының валенттiк электроны  орбиталық импульс моментiнен басқа
орбиталық импульс моментiнен басқа  меншiктi импульс моментi болады, ал электронның толық импульс моментi
меншiктi импульс моментi болады, ал электронның толық импульс моментi 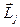 осы моменттердiң қосындысы болып табылады. Моменттердi қосу кванттық заңдар бойынша iске асырылады, Lj шамасы тек дискреттi мәндер қабылдай алады:
осы моменттердiң қосындысы болып табылады. Моменттердi қосу кванттық заңдар бойынша iске асырылады, Lj шамасы тек дискреттi мәндер қабылдай алады: 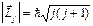 , мұндағы j-iшкi кванттық сан, l+s, l-s мәндер қабылдайды. l=0 болғанда j=1/2 тек бiр мән қабылдайды. l нөлден өзгеше болғанда, j-дiң екi мәнi болады: j=l±1/2.
, мұндағы j-iшкi кванттық сан, l+s, l-s мәндер қабылдайды. l=0 болғанда j=1/2 тек бiр мән қабылдайды. l нөлден өзгеше болғанда, j-дiң екi мәнi болады: j=l±1/2.
Электрондардың механикалық импульс моменттерiмен магниттiк дипольдық моменттер байланысқандығы белгiлi, бұлар бiрiмен-бiрi тогы бар екi контур сияқты әсерлеседi. Осы әсерлесу энергиясы орбиталық және спиндiк магниттiк моменттердiң өзара бағдарлануына байланысты болады. Демек, j мәнi әр түрлі күйлердiң энергиялары да әр түрлі болуға тиiс. Энергияның стационарлық мәндерiн спин-орбиталық әсерлесудi ескерiп табу есебiн кванттық механикалық шешу энергия мәндерi ендi n, l, j ұш кванттық сандарына тәуелдi болатындығын көрсетедi, демек E=Enlj.. Осы теориялық нәтиже тәжiрибеде жақсы расталады.
Көп электронды атомдар үшін толық орбиталық және спиндiк импульс моменттерi жеке электрондардың импульс моменттерiнен қосылады. Осы жағдайда тұйықталған қабықшалар (электрондармен толтырылған) үшін импульстың қосынды моментi нөлге тең болады. Бүтiндей алғанда атом толмаған электрондық қабықшалардағы электрондардың (мысалы, валенттiк) қосынды импульс моментiмен сипатталады.
Валенттiк электрондардың орбиталық және спиндiк импульс моменттерi кеңiстiктiк квантталудың (векторлардың өзара орналасуы) кванттық-механикалық заңдары бойынша, толық импульс моментiнiң  қосынды векторын құрап, қосылады. Осындай қосу нәтижесi қосындылау ретiне тәуелдi болады. Әдетте екi модельдiк жағдай қарастырылады.
қосынды векторын құрап, қосылады. Осындай қосу нәтижесi қосындылау ретiне тәуелдi болады. Әдетте екi модельдiк жағдай қарастырылады.
1) алдымен валенттiк электрондардың жеке орбиталық және спиндiк моменттерi қосылады: атомның толық орбиталық және толық спиндік моменттері анықталады, бұдан кейiн қосынды импульс моментi анықталады (LS-байланыс, Рассель-Саундерс байланысы);
2)
| |
Тәжiрибеде алынған спектрлердi талдау қосындаудың қандай ретi iске асатындығын, демек қандай байланыс берiк (әр түрлі электрондардың спиндерiнiң байланысы ма, әлде әрбiр электронның спиндiк және орбиталық моменттерiнiң байланысы ма) екендiгiн анықтауға мүмкіндiк бередi. Көпшiлiк жағдайда (электрон саны көп емес атомдар үшін) байланыстың бiрiншi түрі (LS-байланыс) орын алады.
6.1-суретте екi валенттiк электроны бар атомның LS-байланысы жағдайында орбиталық және спиндiк импульс моменттерi қосылуының векторлық схемасы келтiрiлген. Осындай атомның қорытқы импульс моменттерiнiң сандық мәндерi мына өрнектермен анықталады
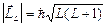 ; L=l1+l2, l1+l2-1,... êl1-l2ç;
; L=l1+l2, l1+l2-1,... êl1-l2ç;
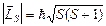 ; S=s1+s2, s1-s2;
; S=s1+s2, s1-s2;
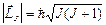 ; J=L+S, L+S-1,..., êL-S ê (6.1)
; J=L+S, L+S-1,..., êL-S ê (6.1)
мұндағы l1 және l2, s1 және s2-валенттiк электрондардың орбиталық және спиндiк кванттық сандары. Екi валенттiк электроны бар атом үшін S=0 немесе 1 бола алады, ал LS екi мән қабылдайды: LS=0 және  .
.
Атомның J кванттық сан мәнi әр түрлі күйлерi орбиталық және спиндiк импульс моменттерiнiң әр түрлі өзара бағдарлануларына сәйкес келедi. Мұндай күйлер сондықтан әр түрлі энергиямен сипатталады.
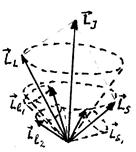
6.1-сурет
| |
Деңгейшелер саны мультиплеттiк деп аталады. Екi электроннан тұратын жүйеде s=0 және s=1, демек, мультиплеттiк 1 және 3-ке тең бола алады, дара деңгейлер (синглеттер) және триплеттiк деңгейлер түзіледi. Энергия деңгейлерiнiң мультиплеттiгiнен атомның шығару спектрiндегi сызықтардың өзара орналасуында өзiне тән заңдылықтар пайда болады. Спектрлердi талдау ең алғаш атомдардың энергетикалық деңгейлерiнiң салыстырмалы орналасуы, және атомдардың электрондық құрылымы жөнiнде деректер алуға, және де энергетикалық деңгейлердiң мультиплеттiк түзілiсiн электронның өзiне тән, өзгеше және елеулi қасиетi-спиндiк импульс моментiмен байланыстыруға мүмкіндiк бердi.
Жұмыста Cd, Hg, Zn атомдары буларының сәуле шығару спектрi зерттеледi. Cd, Hg, Zn атомдарының сыртқы электрондық қабықшасында екi электрон болады, iшкi қабықшалардың қорытқы 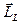 және
және  импульс моменттерi нөлге тең.
импульс моменттерi нөлге тең.
6.2-суретте сынап атомының энергетикалық деңгейлер схемасы және бұлардың арасында мүмкін болатын ауысулар келтiрiлген. Қалыпты (негiзгi) күйде сыртқы электронның екеуi де 6s-электрондар болып табылады, өйткенi бұлардың бас кванттық сандары n=6, ал орбиталық кванттық сандары l=0. Электрондардың бiреуi әрқашан қозбаған 6s-күйде қалып қояды, ал екiншiсi кванттық сандары өзгерiп, қоздырылады. l1=0 күйiнде қалатындықтан, қорытқы L саны l2-мен дәл келедi. Қорытқы спиндiк импульс моментi, жоғарыда айтылғандай, s=0 және s=1 болады.
Көп электронды атомдардағы спектрлiк сызықтардың пайда болуына жауапты электрондардың энергетикалық деңгейлерiн (күйлерiн) 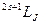 термдермен сипаттайды, мұндағы LºS, P, D,... (L=0, 1, 2,...cандары үшін). Терм белгiсiндегi жоғарғы сол жақтағы индекс деңгейдiң мультиплеттiгiн, төменгi оң жақтағы индекс-J санын анықтайды.
термдермен сипаттайды, мұндағы LºS, P, D,... (L=0, 1, 2,...cандары үшін). Терм белгiсiндегi жоғарғы сол жақтағы индекс деңгейдiң мультиплеттiгiн, төменгi оң жақтағы индекс-J санын анықтайды.
6.1-кесте
| 1-элек трон | 2-элек трон | L | S=0 | S=1 | ||
| J | терм | J | Терм | |||
| 6s | 6s | 1S0 | 3S1 | |||
| 6s | 6p | 1P1 | 0,1,2 | 3P0; 3P1; 3P2 | ||
| 6s | 7s | 1S0 | 3S1 | |||
| 6s | 7p | 1P1 | 0,1,2 | 3P0; 3P1; 3P2 | ||
| 6s | 6d | 1D2 | 1,2,3 | 3D1; 3D2; 3D3 |
| |
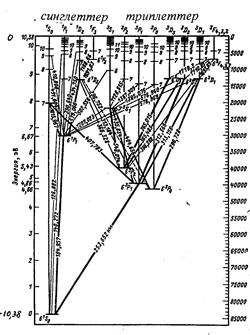
6.2-сурет
Сынап атомының мүмкін күйлерi 6.1-кестеде келтiрiлген.
6.2-суретте тiк бағытта атомның толық энергиясы салынған. Атом энергиясының нөлдiк мәнiне атомнан бiр электронды бөлiп алуға сәйкес энергия алынған, сондықтан атом энергиясы терiс болады. 6, 7, 8... сандары валенттiк электронның n=1,2,3,4,5 қабықшаларда сынап атомының 78 iшкi электроны орналасқан. Бұл электрондар оптикалық спектрдiң шығарылуына қатыспайды. Сынап атомының қалыпты (негiзгi) күйiне сәйкес энергия деңгейi (61S0) 10,43 эВ тереңде жатыр; бұл сынап атомының иондану жұмысы 10,43 эВ болады деген мағына бiлдiредi. 6.2-суретте деңгейлер арасындағы мүмкін кванттық ауысулар да кескiнделген (ауысулар кезiнде DL=±1, DJ=0,±1 кванттық-механикалық сұрыптау ережелерi орындалады).
Сынап атомының сипаттаушы спектрлiк сызықтары мына кванттық ауысуларға сәйкес келедi:
6 3Р1 ® 61S0 -l=253,7 нм; 7 3S1 ® 6 3Р1 -l2=435,8нм;
7 3S1 ® 6 3Р0 -l1=546,1нм; 7 3S ® 6 3Р2 -l3=404,7нм;
| |
Дата добавления: 2014-10-31; просмотров: 400; Мы поможем в написании вашей работы!; Нарушение авторских прав |