
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теориялық кiрiспе
Сiлтiлiк металл атомдарының спектрлiк сызықтарын ажыратқыштық қабілетi жоғары құралдармен зерттегенде осы сызықтардың әрқайсысы қос сызықтан (дублет) тұратындығы - күрделi екендiгi ашылды. Сызықтардың осылай құраушыларға жiктелуi спектрдiң нәзiк түзілiсi деп аталады. Жақын орналасқан бiрнеше құраушылардан тұратын спектрлiк сызықтарды мультиплеттер деп атайды. Әр түрлі атомдардың мультиплеттегi құраушылар саны екiге (дублет), үшке (триплет), төртке (квартет) және т.т. тең болуы мүмкін; дара спектрлiк сызықтар да болады, бұлар синглеттер деп аталады.
| |
| элемент | Z | Dl, нм |
| Li | 0,015 | |
| Na | 0,6 | |
| K | 3,4 | |
| Cs | 42,2 |
Спектрлiк сызықтардың жiктелуi, араларында кванттық ауысулар болатын энергия деңгейлерiнiң жiктелуiмен байланысты болуға тиiс. Басқаша айтқанда спектрлiк сызықтың нәзiк түзілiсi электронның энергия деңгейлерiнiң нәзiк түзілiсiмен байланысты болуға тиiс.
Сiлтiлiк металдар атомдарының энергетикалық спектрiн қарастырайық.
5.3.1. Сiлтiлiк металдар атомдарының энергетикалық спектрi
Сiлтiлiк металл атомы ядроның кулондық өрiсiндегi көп электрондар жүйесi болғандықтан мұның энергетикалық спектрiн есептеу қиын әрi күрделi болып табылады. Сондықтан мынадай әдiс қолданылады-есептеудi жеңiлдететiн ұйғарым жасалады: атомның iшкi қабатындағы электрондар ядроға жақын орналасқан (ядро және iшкi қабаттардағы электрондар атомдық қалдық түзеп тұрады), ал атоммен әлсiз байланысқан сыртқы электрон, керiсiнше, ядродан жеткiлiктi үлкен қашықтықта болады деп ұйғарып, сiлтiлiк металл атомы сутегi тәрiздi жүйе ретiнде қарастырылады (сыртқы электрон-атомдық қалдық). Осылай қарастырғанда, сыртқы электронның атомның қалған электрондарымен әсерлесуi, атомдық қалдықтың сыртқы электронды кулондық тартылысына қабаттасатын болмашы ұйытқу ретiнде ескерiледi; ал осы жағдайдағы атом энергиясы үшін сутегi атомының энергия өрнегiне ұқсас өрнек алынады;
 (5.1)
(5.1)
| |
 қатынасымен анықталатын тиiстi деңгейлерiнен төмен орналасатындығы көрiнедi. Бұдан басқа Dl кванттық ақау l орбиталық санға күштi тәуелдi болатындықтан, сiлтiлiк металл атомындағы оптикалық электронның энергиясы n бас кванттық сан мәнiне ғана емес, l орбиталық кванттық санға да тәуелдi болады. Және бұл l-ге тәуелдiлiк l мәнi өскен сайын әлсiрей бередi (4-жұмысты қараңыз).
қатынасымен анықталатын тиiстi деңгейлерiнен төмен орналасатындығы көрiнедi. Бұдан басқа Dl кванттық ақау l орбиталық санға күштi тәуелдi болатындықтан, сiлтiлiк металл атомындағы оптикалық электронның энергиясы n бас кванттық сан мәнiне ғана емес, l орбиталық кванттық санға да тәуелдi болады. Және бұл l-ге тәуелдiлiк l мәнi өскен сайын әлсiрей бередi (4-жұмысты қараңыз).
5.3.2. Сутегi атомы энергетикалық деңгейлерiнiң нәзiк түзілiсi
Сутегi атомы энергетикалық деңгейлерiнiң нәзiк түзілiсiн екi физикалық фактор туғызады: 1) релятивтiк эффект-атомдағы электрон массасының оның ядроны айнала қозғалғандағы жылдамдығына тәуелдiлiгi; 2) электронның меншiктi магнит моментi мен электронның ядроны айнала қозғалысы туғызатын магнит өрiсiнiң әсерлесуi.
Электронның спинi және оның орбиталық қозғалысымен байланысты фактор да релятивтiк болып табылады.
Шредингер теңдеуi көмегiмен атомның энергетикалық спектрiн есептеген кезде бұл факторларды ескеру мүмкін емес, өйткенi теңдеу салыстырмалық теорияны қанағаттандырмайды.
Сондықтан Шредингер теңдеуi көмегiмен атомның энергетикалық спектрiнiң нәзiк түзілiсiн бейнелеуге болмайды. Атомның энергетикалық спектрiн және оның нәзiк түзілiсiн арнайы салыстырмалылық теория талаптарын қанағаттандыратын Дирак теңдеуi көмегiмен дәл есептеп табуға болады. Бiрақ, басқаша жасауға да болады. Дирак теңдеуiн қолданбай-ақ, нәзiк түзілiс формуласын онша дәлме-дәл болмағанымен, қарапайым жолмен қорытып шығаруға болады. Сонда онша дәлме-дәл емес, бiрақ физикалық көрнекi амалды қолданып, сутегi атомының негiзгi күйлерiне жоғарыда аталған факторлардың әрқайсысы тудыратын энергетикалық түзетулер қарастырылады.
Релятивтiк эффектiң атомның энергетикалық күйлерiне әсерiн ең алғаш Зоммерфельд (1916) қарастырған. Е0 энергетикалық деңгейiне релятивтiк энергетикалық түзету мына формуламен анықталады:
 (5.2)
(5.2)
мұнда  -нәзiк түзілiс тұрақтысы;
-нәзiк түзілiс тұрақтысы;  -сутегi атомының релятивтiк эффектер ескерiлмегендегi энергиясы. DЕР түзетуiнiң шамасы өте кiшi, реттiк шамасы a2Е0~10-3эВ болады.
-сутегi атомының релятивтiк эффектер ескерiлмегендегi энергиясы. DЕР түзетуiнiң шамасы өте кiшi, реттiк шамасы a2Е0~10-3эВ болады.
| |
 , ал
, ал  -электронның меншiктi магниттiк моментi болсын дейiк. Сонда спин-орбиталық әсерлесу энергиясы DЕls мынаған тең
-электронның меншiктi магниттiк моментi болсын дейiк. Сонда спин-орбиталық әсерлесу энергиясы DЕls мынаған тең
 (5.3)
(5.3)
Электронның меншiктi магниттiк моментi:
 (5.4)
(5.4)
 , мұндағы
, мұндағы  (5.5)
(5.5)
 (5.6)
(5.6)
 -электронның меншiктi импульс моментi, m0-Бор магнетоны, s-спиндiк кванттық сан (s=1/2).
-электронның меншiктi импульс моментi, m0-Бор магнетоны, s-спиндiк кванттық сан (s=1/2).
Спин-орбиталық әсерлесудi бейнелеу үшін, және де атомдардың спектрлерiн жүйелеу үшін атомның векторлық моделi қолданылады. Осы модельде электронның-орбиталық қозғалысына сәйкес импульс моментi  векторымен, ал оның спинi-
векторымен, ал оның спинi-  векторымен берiледi. Спин-орбиталық әсерлесу арқасында электронның
векторымен берiледi. Спин-орбиталық әсерлесу арқасында электронның  орбиталық моментi оның
орбиталық моментi оның  спиндiк моментiмен қосылады.
спиндiк моментiмен қосылады.
Қорытқы вектор 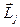 =
=  +
+  электронның толық импульс моментiнiң векторы деп аталады.
электронның толық импульс моментiнiң векторы деп аталады.
 ; j-iшкi кванттық сан.
; j-iшкi кванттық сан.
 ; l-орбиталық кванттық сан.
; l-орбиталық кванттық сан.
Спин-орбиталық әсерлесу  энергиясы үшін өрнек түрлендiру соңында мына түрге келедi
энергиясы үшін өрнек түрлендiру соңында мына түрге келедi
| |
 (5.7)
(5.7)
(5.7) өрнегiмен спин-орбиталық әсерлесуге энергетикалық түзету шамасы  және
және  векторларының өзара бағдарлануына байланысты, яғни
векторларының өзара бағдарлануына байланысты, яғни 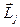 -ге байланысты болатындығы көрiнедi. Бұған қоса бiр электронды атомда l берiлген жағдайда j кванттық саны j1=l+1/2, j2=l-1/2 екi мән қабылдайтындықтан, (5.7) өрнегiне сәйкес спин-орбиталық әсерлесу нәтижесiнде Е0 деңгейi жiктелетiн болса,
-ге байланысты болатындығы көрiнедi. Бұған қоса бiр электронды атомда l берiлген жағдайда j кванттық саны j1=l+1/2, j2=l-1/2 екi мән қабылдайтындықтан, (5.7) өрнегiне сәйкес спин-орбиталық әсерлесу нәтижесiнде Е0 деңгейi жiктелетiн болса,  түзетуi болса деңгейдiң ығысуын тудырады. Соңғы қатынастан
түзетуi болса деңгейдiң ығысуын тудырады. Соңғы қатынастан  ~a2Е0 болатындығын көруге болады. Сонымен, эффектiң екеуiнiң де - релятивтiк және спин-орбиталық әсерлесуiмен байланысты-реттiк шамалары бiрдей болады екен: a2Е0 ~10-3 эВ.
~a2Е0 болатындығын көруге болады. Сонымен, эффектiң екеуiнiң де - релятивтiк және спин-орбиталық әсерлесуiмен байланысты-реттiк шамалары бiрдей болады екен: a2Е0 ~10-3 эВ.
Атомдағы электронның энергиясын анықтағанда  энергетикалық түзетуi
энергетикалық түзетуi  релятивтiк түзетумен қатар ескерiлуi тиiс.
релятивтiк түзетумен қатар ескерiлуi тиiс.
Сонымен, атом энергиясы мынаған тең:
 (5.8)
(5.8)
(5.8) өрнегiне (5.2), (5.7) қатынастарын қойып және бiр электронды атом жағдайында j=l±1/2 болатынын ескерiп, атом энергиясы үшін мына формула алынады:
 (5.9)
(5.9)
мұндағы  (5.10)
(5.10)
Сонымен, екi фактордың екеуiнiң де әсер етуi нәтижесiнде бiр электронды атомның барлық деңгейлерi (5.9) өрнегiне сәйкес j кванттық санының мүмкін мәндерiнiң саны бойынша екi деңгейшеге жiктеледi. Осы жiктелу (оның масштабы кiшi болу себептi) нәзiк немесе мультиплеттiк жiктелу деп аталады. Сондықтан жiктелу масштабын анықтайтын өлшемдiлiксiз a тұрақты-нәзiк түзілiс тұрақтысы деп аталады. (5.9), (5.10) өрнектерiнен деңгейдiң жiктелу шамасы (Еnl бiр деңгейдiң j1=l+1/2 және j2=l-1/2 деңгейшелерi арасындағы энергия айырымы) мынаған тең болатындығы шығады
 (5.11)
(5.11)
| |
 және
және  көрiнедi.
көрiнедi.
5.3.3. Сiлтiлiк элемент атомы энергетикалық деңгейлерiнiң нәзiк түзілiсi
Сутегi атомы энергетикалық деңгейлерiнiң нәзiк түзілiсi үшін қорытылған (5.10) формуланы сiлтiлiк металл жағдайында талдап қорытуға болады.
Сiлтiлiк металл спектрлерiн атомдық қалдық өрiсiндегi сәуле шығарушы валенттiк электрон моделiн пайдаланып түсіндiруге болады. Осы жағдайда, қалған z-1 электрондардан тұратын атомдық қалдықтың ұйытқытушы әсерi былай бiлiнедi: ендi термдер R/n2 Бальмер формуласымен емес,  Ридберг формуласымен өрнектелетiн болса, мұндағы n* тиiмдi бас кванттық сан. Егер осы формуланы
Ридберг формуласымен өрнектелетiн болса, мұндағы n* тиiмдi бас кванттық сан. Егер осы формуланы  түрінде жазатын болсақ, онда ол сiлтiлiк металдың бейтарап атомдары үшін ғана емес (zT=1), бiр валенттi электроны бар иондар үшін де жарамды болады, Mg+ (zT=2), Al++ (zT=3),... және т.т.
түрінде жазатын болсақ, онда ол сiлтiлiк металдың бейтарап атомдары үшін ғана емес (zT=1), бiр валенттi электроны бар иондар үшін де жарамды болады, Mg+ (zT=2), Al++ (zT=3),... және т.т.
Бұдан кейiн түзетудi Бальмер термiнiң бөлiмiне ендiрiп, Ридберг формуласын  түрінде жазу орнына, түзетудi термнiң алымына ендiруге және сол формуланы
түрінде жазу орнына, түзетудi термнiң алымына ендiруге және сол формуланы 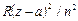 түрінде жазуға болады, мұндағы n, Бальмер формуласындағы сияқты, - бас кванттық сан. а түзетуiнiң физикалық мағынасы айқын: z-а ядроның «тиiмдi» заряды, демек, а шамасы ядро зарядының атомдық қалдық электрондарымен экрандалуын сипаттайды. Осы ескертпелердi сiлтiлiк металл жағдайына сутегi тәрiздi атомның нәзiк түзілiс формуласын жартылай эмпирикалық (тәжiрибелiк) талдап қорыту үшін пайдалануға болады.
түрінде жазуға болады, мұндағы n, Бальмер формуласындағы сияқты, - бас кванттық сан. а түзетуiнiң физикалық мағынасы айқын: z-а ядроның «тиiмдi» заряды, демек, а шамасы ядро зарядының атомдық қалдық электрондарымен экрандалуын сипаттайды. Осы ескертпелердi сiлтiлiк металл жағдайына сутегi тәрiздi атомның нәзiк түзілiс формуласын жартылай эмпирикалық (тәжiрибелiк) талдап қорыту үшін пайдалануға болады.
5.3.1.параграф нәтижелерiнен сiлтiлiк элемент атомындағы валенттiк электронның энергиясын есептегенде электрон спинi ескерiлмегендiктен (5.1) қатынасын дәлдей түсу қажеттiгi, яғни DЕр, DЕls, релятивтiк және спин-орбиталық әсерлесумен байланысты эффектiлердi ескеру қажеттiгi келiп шығады.
DЕр релятивтiк түзетудi және DЕls энергетикалық қосымшаны 5.3.2-де қарастырғанға ұқсас әдiспен iске асырып ескеру (5.1) қатынасын мына түрге келтiредi
| |
 (5.12)
(5.12)
(5.12) формуладан сiлтiлiк элемент атомының барлық энергетикалық деңгейлерiнiң (s-деңгейлерден басқалары) әрқайсысы екi деңгейшеге жiктелетiндiгi (j кванттық санының мүмкін мәндерiнiң саны бойынша) көрiнедi.
Осы (5.12) өрнектен деңгейдiң жiктелу шамасы (n, l деңгейдiң j1=l+1/2, j2=l-1/2 деңгейшелерi энергияларының айырмасы) мынаған тең болатындығы келiп шығады
 (5.13)
(5.13)
(5.13) және (5.11) теңдiктерiн салыстырудан сiлтiлiк элемент атомы энергия деңгейлерiнiң жiктелу шамасы сутегi атомынiкiне қарағанда едәуiр үлкен болатындығы (z-a1 =zT>1; сутегi атомы үшін z=1) және z өскенде тез өсетiндiгi көрiнедi. Бұл мына жағдайға байланысты: деңгейдiң жiктелу шамасы  -қа пропорционал [9], яғни негiзiнен r-дiң кiшi мәндерi аймағымен анықталады. Кiшi қашықтықтарда (атомдық қалдық iшiнде) ядро заряды iшкi қабықша электрондарымен толық экрандалмайды, сондықтан тиiмдi ядро заряды zT>е болады.
-қа пропорционал [9], яғни негiзiнен r-дiң кiшi мәндерi аймағымен анықталады. Кiшi қашықтықтарда (атомдық қалдық iшiнде) ядро заряды iшкi қабықша электрондарымен толық экрандалмайды, сондықтан тиiмдi ядро заряды zT>е болады.
Қазiргi атом теориясына сәйкес атомдағы электрон күйiн n, l, j, mj төрт кванттық сан жиынымен сипаттауға болады. n-бас кванттық сан; бiрiншi жуықтауда атомдағы электрон энергиясын анықтайды және n=1, 2, 3,... мәндерiн қабылдайды. l-орбиталық кванттық сан, электронның орбиталық импульс моментiн анықтайды; l=0, 1, 2,..., n-1 мәндерiн, барлығы n мән қабылдайды.
j-iшкi кванттық сан, атомдағы электронның толық импульс моментiн анықтайды; l және s берiлген жағдайда j=l+s, l+s-1,..., çl+s-1ê, барлығы 2s+1 мән қабылдайды.
mj-магниттiк iшкi кванттық сан, электронның толық импульс моментiнiң оқшауланған бағытқа (магнит өрiсi бағытына) проекциясы шамасын анықтайды. Берiлген j жағдайында mj=j, j-1, j-2,...-j, барлығы 2j+1 мән қабылдайды.
| |
Сiлтiлiк элемент атомындағы оптикалық электронның негiзгi күйi осы белгiлеуде былай жазылады: n 2S1/2, бұған l=0, j=1/2, s=1/2 n=2 (Li үшін), n=3 (Na үшін),... сәйкес келедi.
(5.12) формула негiзiнде және атом күйлерiнiң (деңгейлерiнiң) шартты белгiлеулерiн пайдаланып, сiлтiлiк элемент атомының энергетикалық спектрiн диаграмма түрінде кескiндеуге болады (5.1-сурет).


5.1-сурет
Сұрыптау ережелерi және спектр. Атом күйлерi арасында жарық шығарылып немесе жұтылып өтетiн кванттық ауысулар сұрыптау ережелерi деп аталатын кванттық сандардың өзгеру шамасына қойылатын белгiлi бiр шектеулер жағдайында мүмкін болады.
Егер атомның бастапқы және аяққы күйлерiнiң орбиталық кванттық сандары 1-ге өзгерген жағдайда, яғни
Dl=±1 (5.14)
болғанда, ал осы күйлердiң толық моментiнiң кванттық саны 1-ге өзгергенде, немесе бiрдей мәндерге ие болғанда (тек 0 емес), яғни
Dj=0, ± 1 (5.15)
болған жағдайларда ауысулар мүмкін болады. l және j кванттық сандарының басқаша өзгерiстерi жағдайында жарық шығарып немесе жұтып өтетiн кванттық ауысуларға тиым салынады. Кванттық ауысулар кезiнде n бас кванттық сан кез-келген шамаға өзгере алады немесе тiптi өзгермейдi.
l бойынша сұрыптау ережелерiне сәйкес натрийдың шығару спектрiнде спектрлiк сызықтардың бiрнеше сериялары пайда болады. Төменгi деңгейлерi ортақ спектрлiк сызықтар серия құрайтындығы белгiлi, және бұлар әдетте бiр спектрлiк аймақта орналасады (ультракүлгiн, көрiнетiн, инфрақызыл).
| |
 толқындық сандары сериялық формулалар деп аталатын қарапайым заңдылықтарға бағынады. Төменде Na атомының сериялары және бұлардың сериялық формулалары (шығару спектрiнде байқалатын) келтiрiлген:
толқындық сандары сериялық формулалар деп аталатын қарапайым заңдылықтарға бағынады. Төменде Na атомының сериялары және бұлардың сериялық формулалары (шығару спектрiнде байқалатын) келтiрiлген:
бас серия 3 2S-n 2P :  ;
;
айқын серия 3 2P-n 2S :  ;
;
диффузиялық серия 3 2P-n 2D :  ;
;
iргелi серия: 3 2D-n 2F :  .
.
мұнда n=4, 5, ...
Егер атом негiзгi күйде тұрған болса (3 2S1/2), онда қоздырған кезде ол, сұрыптау ережелерiне сәйкес, тек Р- күйлерге ауысулар жасай алады, осыдан бас серия (3S- nP) пайда болады. Егер Na атомы 3P-күйде тұрған болса, онда осы күйден S және D күйлерге ауысулар мүмкін болады. Осы жағдайда сұрыптау ережелерiне сәйкес, айқын серияның (3P - nS) және диффузиялық серияның (3P - nD) сызықтары пайда болады. Бас серия жұтылу спектрiнде де байқалады. Аталған сериялардың кейбiр кванттық ауысулары 5.1-суретте көрсетiлген.
Сызықтардың нәзiк түзілiсi. Деңгейлердiң нәзiк түзілiсi белгiлi болса, онда әр түрлі серия сызықтарының жiктелу сипатын анықтау қиын емес. j бойынша сұрыптау ережелерiн (Dj=±1) ескерiп
бас серия-дублеттер 2S1/2 -2P1/2, 2S1/2 -2P3/2;
айқын серия-дублеттер 2P1/2 - 2S1/2 , 2P1/2 - 2S1/2;
диффузиялық серия-
триплеттер 2P1/2-2D3/2,2P3/2-2D3/2, 2P3/2-2D5/2
iргелi серия-триплеттер 2D3/2-2F5/2, 2D5/2-2F5/2, 2D5/2-2F7/2
болатындығын табамыз.
| |
Триплеттiң 2P1/2-2D3/2 және 2P3/2-2D3/2 екi құраушысының ара қашықтығы төменгi деңгейдiң жiктелуiмен анықталады және ол серияның барлық сызықтары үшін тұрақты болады (5.3-сурет).

5.2-сурет 5.3-сурет
2P3/2-2D3/2 және 2P3/2-2D5/2 құраушыларының жоғарғы деңгейдiң жiктелуiмен анықталатын ара қашықтығы болса, шамасы бойынша едәуiр кiшi және серияның жоғарғы мүшелерi үшін тез кемидi. Спектрлiк құралдың ажыратқыштық қабілетi онша үлкен болмаған жағдайда осы құраушылар ажыратылмайды да диффузиялық серия сызықтар дублеттер болып көрiнедi. Осы сияқты iргелi серия сызықтарының құрылымын оңай түсіндiруге болады.
Дата добавления: 2014-10-31; просмотров: 816; Мы поможем в написании вашей работы!; Нарушение авторских прав |