
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ ТИТОВАНИЕ
Пример: Навеска бихромата калия 0,1180 г в кислой среде обработана йодидом калия и оттитрована раствором тиосульфата натрия, которого израсходовано 23,80 см3. Чему равен титр раствора тиосульфата натрия?
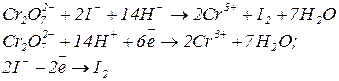 ;
; 

141. Для анализа взято 0,1254 г бихромата калия и растворено. Выделенный из иодида калия йод, оттитрован 24,85 см3 0,09978 (Na2S2O3´5H2O) вычислить массовую долю (%) оксида хрома (6) в образце.
142. К 10,00 см3 сероводородной воды прибавлено 50,00 см3 раствора йода, на титрование избытка которого потребовалось для титрования 32,79 см3 раствора тиосульфата натрия. Вычислить % сероводорода в воде, если поправочный коэффициент К = 1,1120 к 0,1 М (1/2 I2), а К = 0,9730 к 0,1 M. (Na2S2O3´5 H2O).
143. Сколько процентов нитрита натрия содержит технический образец, если после растворения 1,3074 г этого образца в 500,0 см3 на титрование 25,00 см3 0,09815 (1/5 KMnO4) 35,11 см3 этого раствора.
144. Сколько процентов FeC2O4 содержит образец, если навеска его равна 0,2596 г и на окисление его затрачивается 44,77 см3 раствора KMnO4, для которого K = 1,156; С (1/5 KMnO4) = 0,1 моль/ см3.
145. Сколько процентов сурьмы содержит сплав, если навеска его 1,000 г после растворения оттитрована 42,50 см3 раствора KMnO4 c  = 0,006124 г/ дм3
= 0,006124 г/ дм3
146. Сколько процентов Fe2O3 содержит образец, если его навеска 0,1700 г после растворения и восстановления железа оттитрована 38,4 см3 раствора KMnO4 c  = 0,0001100 г/ см3.
= 0,0001100 г/ см3.
147. Для определения массовой доли изопропанола в техническом продукте навеску его 1,5000 г обработали 50,00 см3 1,000 М (1/6 K2Cr2O7) в растворе H2SO4 в течении 30 минут. Затем объем раствора довели до 500,0 см3, отобрали 25,00 см3 и определили в нем иодометрически избыток K2Cr2O7: прибавили KI, выдержали 10 мин, выделившийся йод оттитровали 0,1000 М Na2S2O3 в присутствии крахмала. На титрование израсходовано 12,45 см3 Na2S2O3. При взаимодействии изопропанола с K2Cr2O7 спирт окисляется до ацетона по реакции:

Определить массовую долю изопропанола.
148. Для определения примеси этанола в эфире его отогнали из навески эфира 3,5000 г. Полученный дистиллят обработали 10,00 см3 0,2000 М (1/6 K2Cr2O7) в сернокислой среде при нагревании. После охлаждения и разбавления водой к раствору добавили 5 мл 10 %-ного раствора KI, выделившийся йод оттитровали 0,1 М Na2S2O3, на титрование затрачено 14,85 см3. Определить массовую долю этанола. При взаимодействии этанола с K2Cr2O7 он окисляется до уксусной кислоты.
149. Навеска 1,150 г H2O2 разбавлена в мерной колбе на 250 см3. На титрование 25,00 см3 этого раствора расходуется 30,25 см3 раствора перманганата калия  = 0,0004542 г/ см3. Сколько % активного кислорода содержит образец перекиси?
= 0,0004542 г/ см3. Сколько % активного кислорода содержит образец перекиси?
150. Навеска 0,0921 г хромотропового ангидрида растворена, обработана KI и HCl и оттитрована 23,75 см3 раствора тиосульфата  = 0,01354. Сколько % CrO3 содержал образец?
= 0,01354. Сколько % CrO3 содержал образец?
151. Сколько Na2S содержится в исследуемом образце, если была взята навеска 0,9282 г образца и растворена в 250 см3. К 25 см3 полученного раствора добавили 40 см3 0,1011 М (1/2 I2), избыток которого был оттитрован 24,4 см3 0,1038 М (Na2S2O3).
152. 1,2116 г. Белильной извести растворено в колбе на 250 см3 и обработано KI в кислой среде. На титрование выделившегося йода из 25,00 см3 раствора извести израсходовано 23,50 см3 0,1036 М (Na2S2O3) Определить % хлора в белильной извести.
153. Навеску сплава меди массой 2,536 г. растворили в азотной кислоте. Раствор довели до метки в мерной колбе 200,0 см3, отобрала 15,00 см3 этого раствора, добавили избыток KI, а выделившийся оттитровали 0,049 М (Na2S2O3´5H2O) концентрация которого определялось отдельно. На титрование пошло 8,7 см3 тиосульфата натрия. Определить массовую долю меди в сплаве.
154. Для анализа стали на содержание марганца, растворили 0,3510 г. образца. Марганец окислен до HMnO4, на титрование которой израсходовано 8,43 см3 К = 1,004 к 0,03 (1/2 Na3AsO3.). Сколько % марганца содержал образец стали.
155. Для определения концентрации раствора арсенита натрия взяли 0,1182 г стандартного образца стали, с массовой долей марганца 0,84%. После соответствующей обработки, в результате которой Mn2+ превратился в MnO–4. На титрование полученной HMnO4 израсходовали 22,27 см3 раствора арсенита натрия. Чему равен титр арсенита натрия по марганцу.
156. Для определения содержания олова в сплавах его превращают в SnSO4, который титруют рабочим раствором йода без доступа воздуха. Определить содержание олова в бронзе, если навеска бронзы 0,9122 г объем раствора йода, пошедшего на титрование – 15,73 см3; 0,03523 М (1/2 I2).
157. Найти массовую долю сульфита натрия Na2SO3 в образце, если 0,7346 г его было растворено в колбе на 100,0 см3. Полученным раствором титруется 20,00 см3 0,0544 М (1/2 I2), при этом расходуется 23,15 см3 анализируемого раствора.
158. К 25 см3 раствора H2O2 прибавили 50,00 см3 0,01960 М (1/2 I2). Избыток йода, не вступивший в реакцию, оттитровали 0,02040 М (Na2S2O3), которого пошло 11,00 см3. Сколько перекиси водорода содержал 1 дм3 исходного раствора.
159. Для определения свинца навеска руды 5,000 г была растворена в кислоте, свинец был осажден в виде PbCrO4, осадок отфильтрован, промыт и растворен в смеси HCl и KI. Выделившийся при этой реакции йод оттитровали 0,5000 М (Na2S2O3·5H2O), было израсходовано 42,00 см3 титранта. Сколько % свинца в руде?
160. Определить массу салицилата натрия (C7H5O3Na), если его растворили в мерной колбе на 100,0 см3, отобрали пипеткой 20,00 см3, прибавили 25,00 см3 смеси 0,1 М (1/6 KBrO3), 1 г KBr и 4М HCl. После перемешивания дают постоять, вносят 1 г KI и 2-3 см3 хлороформа. Выделившийся йод оттитровали 0,1000 М (Na2S2O3), которого пошло на титрование 20,53 см3.
Дата добавления: 2015-04-15; просмотров: 804; Мы поможем в написании вашей работы!; Нарушение авторских прав |