
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Максимальная работа при постоянном давлении равна
А  = -DH + TDS (16)
= -DH + TDS (16)
или
А  = -(H2 – H1) + T(S2 – S1) = -[(H2 – TS2) – (H1 – TS1)] (17)
= -(H2 – H1) + T(S2 – S1) = -[(H2 – TS2) – (H1 – TS1)] (17)
где H1, S1 и H2, S2 – величина энтальпии и энтропии системы в исходном и конечном состояниях соответственно.
Разность (H – TS) называют энергией Гиббса системы и обозначают буквой G. Таким образом,
А  = -DG. (18)
= -DG. (18)
Энергия Гиббса химической реакции.Энергия Гиббса G (изобарно-изотермический потенциал) термодинамическая функция состояния системы (кДж/моль). Изменение энергии Гиббса в системе при протекании химической реакции DG называют энергией Гиббса химической реакции. Согласно уравнениям (16) и (18),
DG = DH - TDS, (19)
где DG,DH и DS – изменение соответствующих термодинамических функций в ходе реакции, протекающей при р = const и температуре Т.
Данную формулу целесообразно использовать при условиях отличных от стандартных.
Исходя из (19), энергия Гиббса химической реакции характеризует направление и предел самопроизвольного протекания реакции в условиях постоянства температуры и давления.
Энергия Гиббса химической реакции DG, являясь изменением термодинамической функции состояния системы, равна сумме энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ с учетом их стехиометрических коэффициентов в уравнении реакции.
DGх.р. = S DGобр. (прод. р-ции) - S DGобр (исх. в-в.) (20)
Стандартная энергия Гиббса химической реакции DG  равна разности сумм стандартных энергий Гиббса образования DG
равна разности сумм стандартных энергий Гиббса образования DG  , обр продуктов реакции и исходных веществ с учетом их стехиометрических коэффициентов в уравнении реакции.
, обр продуктов реакции и исходных веществ с учетом их стехиометрических коэффициентов в уравнении реакции.
Стандартной энергией Гиббса образования химического соединения DG  , обр называют энергию Гиббса реакции образования одного моля этого соединения, находящегося в стандартном состоянии, из соответствующих простых веществ, также находящихся в стандартных состояниях и термодинамически устойчивых при данной температуре фазах и модификациях (таблица А.1).
, обр называют энергию Гиббса реакции образования одного моля этого соединения, находящегося в стандартном состоянии, из соответствующих простых веществ, также находящихся в стандартных состояниях и термодинамически устойчивых при данной температуре фазах и модификациях (таблица А.1).
Стандартные энергии Гиббса образования простых веществ принимают равными нулю, если их агрегатные состояния и модификации устойчивы при стандартных условиях.
Энергия Гельмгольца химической реакции.Энергия Гельмгольца также является термодинамической функцией состояния системы (кДж/моль). Изменение энергии Гельмгольца в системе при протекании реакции называют энергией Гельмгольца химической реакции. Согласно (15) и (17),
DF = DU -TDS (21)
где DF, DU и DS – изменение соответствующих термодинамических функций в ходе реакции, протекающей при V= const и температуре Т.
Величина DF характеризует направление и предел самопроизвольного течения реакций в изохорно-изотермических условиях.
На рисунке 1 приведены соотношения между основными термодинамическими функциями состояния системы.
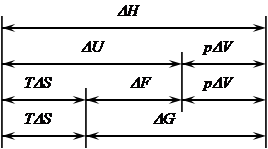 |
Рисунок 1 – Соотношение важнейших термодинамических функций.
Направление и пределы самопроизвольного течения химических реакций.В соответствии с (15) и (18) положительной максимальной работе А 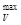 или А
или А  отвечают отрицательные значения энергии Гельмгольца DF и энергии Гиббса DG химических реакций. Иными словами, при постоянных температуре и давлении (изобарно-изотермические условия) реакция протекает самопроизвольно в том направлении, которому отвечает убыль энергии Гиббса системы. Поэтому условием самопроизвольного течения химической реакции при заданных р и Т является неравенство
отвечают отрицательные значения энергии Гельмгольца DF и энергии Гиббса DG химических реакций. Иными словами, при постоянных температуре и давлении (изобарно-изотермические условия) реакция протекает самопроизвольно в том направлении, которому отвечает убыль энергии Гиббса системы. Поэтому условием самопроизвольного течения химической реакции при заданных р и Т является неравенство
DG<0. (22)
При постоянных температуре и объеме реакция протекает самопроизвольно в том направлении, которому отвечает убыль энергии Гельмгольца системы. Поэтому условием самопроизвольного течения химической реакции при заданных V и Т является неравенство
DF<0. (23)
Итак, любая реакция при постоянных температуре и давлении протекает самопроизвольно в направлении убыли энергии Гиббса.
Пределом этой убыли является минимальное значение G, отвечающее состоянию равновесия системы (DG=0). Исходя из этого можно определить температуру химического равновесия из определения энергии Гиббса:
T = DH/DS . (24)
Химическое равновесие имеет динамический характер. Скорость реакции (число частиц вещества, образующихся в единицу времени в единице объема) в прямом направлении равна скорости реакции в обратном направлении.
Однако необходимо понимать, что термодинамика «не знает», пойдет ли реакция в действительности, а говорит только, что она термодинамически разрешена, т.е. в принципе возможна. Однако это не значит, что термодинамические расчеты бесполезны – если термодинамика утверждает, что какая-либо реакция термодинамически разрешена, то можно подобрать условия (подходящий катализатор, температуру, давление) и осуществить ее. В том случае, когда реакция термодинамически запрещена, бессмысленно искать пути ее реализации.
Дата добавления: 2015-04-16; просмотров: 339; Мы поможем в написании вашей работы!; Нарушение авторских прав |