
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ. Задача 1. Вычислите тепловой эффект образования NH3 из простых веществ при стандартных условиях по тепловым эффектам реакций:
Задача 1. Вычислите тепловой эффект образования NH3 из простых веществ при стандартных условиях по тепловым эффектам реакций:
2Н2 + О2 = 2Н2О(ж); DНо1 = -571,68 кДж, (1)
4NH3 + 3О2 = 6Н2О(ж) + 2N2; DНо2 = -1530,28 кДж. (2)
Решение. Запишем уравнение реакции, тепловой эффект которой необходимо определить:
1/2N2 + 3/2Н2 = NH3, (3);
DН 
 = ?
= ?
В уравнения (1) и (2) входят Н2О(ж) и О2, которые не входят в уравнение (3), поэтому, чтобы исключить их из уравнени1 (1) и (2), умножим уравнение (1) на 3 и вычтем из него (2):
6Н2 + 3О2 – 4NH3 – 3О2 = 6Н2О(ж) – 6Н2О(ж) – 2N2(г) (4)
После преобразования уравнения (4) и деления его на 4 получаем искомое уравнение (3). Аналогичные действия проделываем и с тепловыми эффектами
(DНо1×3 - DНо2):4 = DНо3.
В результате получаем: [-571,68×3 – (-1530,28)]:4 = - 46,19 кДж.
Ответ: DН 
 = - 46,19 кДж/моль.
= - 46,19 кДж/моль.
Задача 2. В какой из перечисленных ниже реакций тепловой эффект DН  будет стандартной теплотой образования SO3(г):
будет стандартной теплотой образования SO3(г):
а) S(г) + 3/2О2(г) = SO3(г);
б) SO2(г) + 1/2О2 = SO3(г);
в) S(к) + 3/2О2(г) = SO3(г)?
Решение. В реакции (а) одно из исходных веществ S(г) находится в неустойчивой фазе, поэтому тепловой эффект реакции (а) не может быть DН . В реакции (б) – одно из исходный веществ, а именно SO2(г), не является простым веществом; и только в реакции (в) тепловой эффект соответствует стандартной теплоте образования DН .
Задача 3. Рассчитайте стандартный тепловой эффект реакции:
Fe2O3(к) + 3Н2(г) = 2Fe(к) + 3Н2О(г)
по известным величинам стандартных теплот образования исходных веществ и продуктов реакции. Величины DН  приведены в приложении.
приведены в приложении.
Решение. Согласно следствию из закона Гесса, стандартная энтальпия химической реакции равна сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ с учетом стехиометрических коэффициентов.
Тепловой эффект данной реакции рассчитывается по уравнению
DН  = 2DН
= 2DН 
 + 3DН
+ 3DН 
 -(DН
-(DН 
 + 3DН
+ 3DН 
 )
)
Поскольку в справочниках DН  приводится в расчете на 1 моль, то при расчете теплового эффекта химической реакции соответствующее значение DН
приводится в расчете на 1 моль, то при расчете теплового эффекта химической реакции соответствующее значение DН  умножается на число моль вещества, участвующего в реакции. Подставляя стандартные теплоты образования из приложения, получаем:
умножается на число моль вещества, участвующего в реакции. Подставляя стандартные теплоты образования из приложения, получаем:
DН  = 3(-241,84) – (-821,3) = 95,78 (кДж),
= 3(-241,84) – (-821,3) = 95,78 (кДж),
где DН 
 и DН
и DН 
 равны нулю.
равны нулю.
Данная реакция идет с поглощением теплоты (DН  > 0), т.е. является эндотермической.
> 0), т.е. является эндотермической.
Задача 4. Сколько теплоты выделится при сжигании 20 литров этилена, взятого при нормальных условиях, если известны стандартные теплоты образования веществ.
Решение. Запишем уравнение процесса:
С2Н4(г) + 3О2 = 2СО2(г) + 2Н2О(ж)
Согласно следствию из закона Гесса, стандартная энтальпия химической реакции равна сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ с учетом стехиометрических коэффициентов.
Тепловой эффект данной реакции рассчитывается по уравнению
DН  = 2DН
= 2DН 
 + 2DН
+ 2DН 
 -(DН
-(DН 
 + 3DН
+ 3DН 
 )
)
Подставляем справочные данные из приложения, получим:
DН  = 2(-396,3) + 2(-285,84) – 52,28 = -1130,72 (кДж).
= 2(-396,3) + 2(-285,84) – 52,28 = -1130,72 (кДж).
Следовательно, при сжигании 1 моль С2Н4 выделяется 1130,72 кДж. Однако, по условию задачи сжигается 20 л этилена, что составляет n = 20,0/22,4 = 0,89 моль С2Н4, где 22,4 л/моль – молярный объем любого газа при нормальных условиях.
Таким образом, при сгорании 0,89 моль С2Н4 выделится 0,89×(1130,72) = 1009,57 кДж теплоты.
Задача 5. Рассчитайте энтропийный и энтальпийный факторы протекания процесса при стандартных условиях:
4HCl(г) + О2 = 2Н2О(г) + 2Cl2(г).
Какой из рассчитанных факторов способствует протеканию процесса в прямом направлении?
Решение. Согласно следствию из закона Гесса и используя данные приложения найдем изменение энтальпии и энтропии системы.
Тепловой эффект данной реакции рассчитывается по уравнению
DН  = 2DН
= 2DН 
 + 2DН
+ 2DН 
 -(4DН
-(4DН 
 + DН
+ DН 
 ) =
) =
= 2(- 241,84) + 0 – (4(- 92,3) + 0) = - 114,48 (кДж),
DS  = 2S
= 2S 
 + 2S
+ 2S 
 -(4S
-(4S 
 + S
+ S 
 ) =
) =
= 2×223 + 2×188,8 –(4×186,7 + 205) = -256,4 (Дж/К)
Энтальпийным фактором процесса является энтальпия реакции. Самопроизвольному протеканию процесса способствует уменьшение энтальпии системы DН  < 0. Энтропийный фактор равен произведению абсолютной температуры на энтропию реакции, т.е. ТDS
< 0. Энтропийный фактор равен произведению абсолютной температуры на энтропию реакции, т.е. ТDS  . Самопроизвольному течению процесса способствует рост энтропии системы DS
. Самопроизвольному течению процесса способствует рост энтропии системы DS  > 0.
> 0.
В нашем случае энтропийный фактор
ТDS  = 298 × (-256,4) = -76407,2 (Дж)
= 298 × (-256,4) = -76407,2 (Дж)
не способствует самопроизвольному протеканию процесса.
Энтальпийный фактор DН  = - 114,48 кДж способствует самопроизвольному протеканию процесса в прямом направлении.
= - 114,48 кДж способствует самопроизвольному протеканию процесса в прямом направлении.
Задача 6. Установите, возможно ли при температурах 298 и 1000 К восстановление оксида Fe (III) до свободного металла по уравнению:
Fe2O3(к) + 3H2(г) = 2Fe(к) + 3Н2О(г)
при стандартных состояниях. Определите температуру равновесия системы. Зависимостью DН  и DS
и DS  от температуры пренебречь.
от температуры пренебречь.
Решение: В приложении найдем значения DН  , S
, S  и DG
и DG  для исходных веществ и продуктов реакции. Рассчитаем стандартные энтальпию, энтропию и энергию Гиббса реакции:
для исходных веществ и продуктов реакции. Рассчитаем стандартные энтальпию, энтропию и энергию Гиббса реакции:
DН  = 2DН
= 2DН 
 + 3DН
+ 3DН 
 – (DН
– (DН 
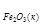 + 3DН
+ 3DН 
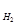 ) =
) =
= 2× 0 + 3× (-241,7) – (- 821,3 + 3 × 0) = 96,2 (кДж),
DS  = 2S
= 2S 
 + 3S
+ 3S 
 – (S
– (S 
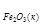 + 3S
+ 3S 
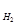 ) =
) =
= 2 × 27,15 + 3 × 188,8 – (89,8 + 3 × 130,6) = 139,1 (Дж/К),
DG  = 2DG
= 2DG 
 + 3DG
+ 3DG 
 – (DG
– (DG 
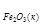 + 3DG
+ 3DG 
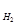 ) =
) =
= 2× 0 + 3× (-228,61) – (- 740,98 + 3 × 0) = 55,18 (кДж).
Для данного процесса при Т = 298К DG  > 0, т.е. невозможно восстановление Fe2O3(к) водородом для получения свободного металла.
> 0, т.е. невозможно восстановление Fe2O3(к) водородом для получения свободного металла.
Рассчитаем энергию Гиббса реакции при 1000 К по формуле:
DG  = DН
= DН  - ТDS
- ТDS  .
.
DG  = 96,2 × 103 – 1000 × 139,1 = – 49,2 (кДж).
= 96,2 × 103 – 1000 × 139,1 = – 49,2 (кДж).
Для данного процесса при Т = 1000 К DG  < 0, т.е. возможно восстановление Fe2O3(к) водородом для получения свободного металла.
< 0, т.е. возможно восстановление Fe2O3(к) водородом для получения свободного металла.
Равновесие в системе наступит при DG  = 0. Исходя из этого, равновесную температуру определим по формуле:
= 0. Исходя из этого, равновесную температуру определим по формуле:
Т = DН  /DS
/DS  = 96,2 × 103/139,1 = 691,59 (К).
= 96,2 × 103/139,1 = 691,59 (К).
Равновесие в системе наступит при температуре 651,9 К.
Дата добавления: 2015-04-16; просмотров: 1917; Мы поможем в написании вашей работы!; Нарушение авторских прав |