
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Оптические свойства коллоидных растворов.
По оптическим свойствам коллоидные растворы существенно» отличаются от истинных растворов низкомолекулярных веществ, а также от грубодисперсных систем. Наиболее характерными оптическими свойствами коллоидно-дисперсных систем являются опалесценция, эффект Фарадея — Тиндаля и окраска. Все эти явления обусловлены рассеянием и поглощением света коллоидными частицами.
В зависимости от длины волны видимого света и относительных размеров частиц дисперсной фазы рассеяние света принимает различный характер. Если размер частиц превышает длину световых волн, то свет от них отражается по законам геометрической оптики. При этом часть светового излучения может проникать внутрь частиц, испытывать преломление, внутреннее отражение и поглощаться.
Если размер частиц меньше длины полуволны падающего света, наблюдается дифракционное рассеяние света; свет как бы обходит (огибает) встречающиеся на пути частицы. При этом имеет место частичное рассеяние в виде волн, расходящихся во все стороны. В результате рассеяния света каждая частица является источником новых, менее интенсивных волн, т. е. происходит как бы самосвечение каждой частицы. Явление рассеяния света мельчайшими частицами получило название опалесценции. Оно свойственно преимущественно золям (жидким и твердым), наблюдается только в отраженном свете, т. е. сбоку или на темном фоне. Выражается это явление в появлении некоторой мутноватости золя и в смене («переливах») его окраски по сравнению с окраской в проходящем свете. Окраска в отраженном свете, как правило, сдвинута в сторону большей частоты видимой части спектра. Так, белые золи (золь хлорида серебра, канифоли и др.) опалесцируют голубоватым цветом.
Эффект Фарадея — Тиндаля. Дифракционное рассеяние света впервые было замечено М. В. Ломоносовым. Позднее, в 1857 г., это явление наблюдал Фарадей в золях золота. Наиболее детально явление дифракции (опалесценции) для жидких и газовых сред было изучено Тиндалем (1868).
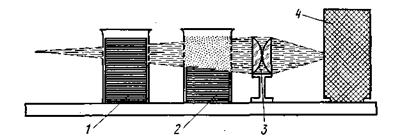
Если взять один стакан с раствором хлорида натрия, а другой — с гидрозолем яичного белка, трудно установить, где коллоидный раствор, а где истинный, так как на вид обе жидкости бесцветны и прозрачны (рис. 6.5). Однако эти растворы можно легко различить, проделав следующий опыт. Наденем на источник света (настольную лампу) светонепроницаемый футляр с отверстием, перед которым в целях получения более узкого и яркого пучка света поставим линзу. Если на пути луча света поставить оба стакана, в стакане с золем увидим световую дорожку (конус), в то время как в стакане с хлоридом натрия луч почти не заметен. По имени ученых, впервые наблюдавших это явление, светящийся конус в жидкости был назван конусом (или эффектом) Фарадея — Тиндаля. Этот эффект является характерным для всех коллоидных растворов.
Появление конуса Фарадея — Тиндаля объясняется явлением рассеяния света коллоидными частицами размером 0,1—0,001 мкм.
Длина волн видимой части спектра 0,76—0,38 мкм, поэтому каждая коллоидная частица рассеивает падающий на нее свет. Он виден в конусе Фарадея — Тиндаля, когда луч зрения направлен под углом к проходящему через золь лучу.Таким образом, эффект Фарадея — Тиндаля —явление, идентичное опалесценции, и отличается от последней только видом коллоидного состояния, т. е. микрогетерогенности системы.
Теория рассеяния света коллоидно-дисперсными системами была разработана Рэлеем в 1871 г. Она устанавливает зависимость интенсивности (количества энергии) рассеянного света (I) при опалесценции и в конусе Фарадея — Тиндаля от внешних и внутренних факторов. Математически эта зависимость выражается в виде формулы, получившей название формулы Рэлея:
Рис.6.5

| 6.1 |
где I — интенсивность рассеянного света в направлении, перпендикулярном к лучу падающего света; К — константа, зависящая от показателей преломления дисперсионной среды и дисперсной фазы; n — число частиц в единице объема золя; λ — длина волны падающего света; V — объем каждой частицы.
Из формулы (6.1) следует, что рассеяние света (I) пропорционально концентрации частиц, квадрату объема частицы (или для сферических частиц — шестой степени их радиуса) и обратно пропорционально четвертой степени длины волны падающего света. Таким образом, рассеяние коротких волн происходит относительно более интенсивно. Поэтому бесцветные золи в проходящем свете кажутся красноватыми, в рассеянном — голубыми.
Проверка формулы Рэлея на опытах показала, что применение ее ограничено. Во-первых, она применима только к золям, в которых вещество дисперсной фазы не является проводником электричества и совершенно неприменима к металлическим золям, так как в окраске их решающую роль играет поглощение (т. е. абсорбция) света. Во-вторых, даже для систем с частицами из непроводников это уравнение применимо только лишь для типичных золей, т. е. для частиц размером от 5 до 100 нм.
Явлением светорассеяния Рэлей объяснял голубой цвет неба, а индийский ученый Раман — цвет морской воды. Однако рассеяние света в этих случаях происходит не за счет присутствия высокодисперсных примесей (например, пылинок, мельчайших капелек воды и т. п.). В 1907 г. Л. И. Мандельштам показал, что рассеянный свет возникает только в оптически неоднородной среде, так как в этом случае показатель преломления среды меняется от одного участка к другому. Позднее Смолуховский (1908) доказал, что такое нарушение однородности среды может возникнуть в результате теплового движения молекул как местное изменение (флуктуация) плотности, т. е. совершенно самопроизвольно на короткое время могут возникать очень малые участки, отличающиеся от соседних своей плотностью. В силу этого возникает разность показателей преломления между отдельными участками атмосферы (или морской воды) и как следствие — рассеяние света.
Явление опалесценции по своим внешним признакам сходно с явлением флуоресценции, природа которого связана с внутримолекулярным процессом. В случае флуоресценции часть падающего светового луча сначала избирательно поглощается, а затем вновь испускается (рассеивается), но уже с иной (обычно большей) длиной волны. Явление флуоресценции присуще в одинаковой мере как коллоидным, так и молекулярным растворам.
Окраска коллоидных растворов.В результате избирательною поглощения света (абсорбции) в сочетании с дифракцией образуется та или иная окраска коллоидного раствора. Опыт показывает, что большинство коллоидных (особенно металлических) растворов ярко окрашено в самые разнообразные цвета, начиная от белого и кончая совершенно черным, со всеми оттенками цветового спектра. Так, золи As2S3 имеют ярко-желтый, Sb2S3 — оранжевый, Fe(OH)3 — красновато-коричневый, золота — ярко-красный цвет и т. п.
Один и тот же золь имеет различную окраску в зависимости от того, в проходящем или отраженном свете она рассматривается. Золи одного и того же вещества в зависимости от способа приготовления могут приобретать различную окраску— явление полихромии (многоцветности). Окраска золей в данном случае зависит от степени дисперсности частиц. Так, грубодисперсные золи золота имеют синюю окраску, большей степени дисперсности — фиолетовую, а высокодисперсные — ярко – красную. Интересно отметить, что цвет металла в недисперсном состоянии не имеет ничего общего с его цветом в коллоидном состоянии.
Необходимо отметить, что интенсивность окраски золей в десятки (а то и в сотни) раз больше, чем молекулярных растворов. Так, желтая окраска золя As2S3 в слое толщиной в 1 см хорошо заметна при массовой концентрации 10-3 г/л, а красный цвет золя золота заметен даже при концентрации 10-5 г/л.
Красивая и яркая окраска многих драгоценных и полудрагоценных камней (рубинов, изумрудов, топазов, сапфиров) обусловлена содержанием в них ничтожных (не определимых даже на лучших аналитических весах) количеств примесей тяжелых металлов и их оксидов, находящихся в коллоидном состоянии. Так, для искусственного получения яркого рубинового стекла, употребляемого для автомобильных, велосипедных и прочих фонарей, достаточно на 1000 кг стеклянной массы добавить всего лишь 0,1 кг коллоидного золота.
Ультрамикроскоп. На явлении светорассеяния в конусе Фарадея — Тиндаля основан один из важнейших методов исследования высокодисперсных систем — с помощью ультрамикроскопа. Ультрамикроскоп был изобретен в 1903 г. Зигмонди и Зидентопфом. Отличительной особенностью ультрамикроскопа (рис. 6.6) является осветительная система, которая состоит из мощной вольтовой дуги 1, щелевой диафрагмы 3 и системы линз 2. Объект исследования помещают в специальную кювету 4, которая крепится на предметном столике микроскопа.
В отличие от обычного микроскопа в ультрамикроскопе применено боковое освещение. При этом свет от осветителя не попадает в объектив микроскопа и в глаз наблюдателя, поэтому фон поля зрения микроскопа темный. При рассматривании в ультрамикроскоп коллоидного раствора (например, золота) можно видеть беспрерывно движущиеся, переливающиеся всеми цветами радуги, разного размера частицы, из которых наиболее мелкие представляют собой светящиеся точки. Интенсивность рассеяния света зависит от концентрации коллоидных частиц, от их размеров и. формы. Поскольку разрешающая сила ультрамикроскопа невелика (не превышает таковую обычных микроскопов, имеющих увеличение в. 300—500 раз), то ни размеры, ни форма частиц в ультрамикроскоп непосредственно не различимы. И все же с помощью ультрамикроскопа можно косвенно судить о размерах и форме коллоидных частиц.
. 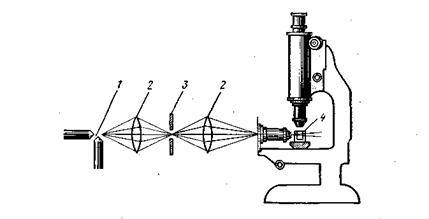
Рис.6.6
Размеры частиц можно определить приближенно путем следующего расчета.
При помощи микрометрической окулярной шкалы ультрамикроскопа выделяют определенный объем золя, в котором визуально подсчитывают число находящихся в нем коллоидных частиц. Зная общую массу диспергированного вещества и вычислив количество частиц во всем объеме, можно рассчитать массу одной частицы и уже по ней, учитывая плотность диспергированного вещества определить объем и размеры частицы. Пусть d — плотность частиц, С — массовая концентрация коллоидного раствора, V — выделенный оптический объем; ν — число частиц в объеме V;
Принимая форму частицы за куб или сферу, можно вычислить размер коллоидной частицы по формуле (6.2):
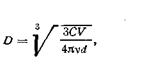
| 6.2 |
где D — диаметр сферической частицы.
Дата добавления: 2014-11-13; просмотров: 1722; Мы поможем в написании вашей работы!; Нарушение авторских прав |