
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Мицеллярная теория строения коллоидной частицы.
Советские ученые А. В. Думанский, Н. Н. Песков, С. М. Липатов, А. Н. Фрумкин, а также зарубежные ученые Веймарн, Паули, Фаянс, Кройт на основе теории двойного электрического слоя создали так называемую мицеллярную теорию строения коллоидных частиц. Первоначально представление о мицеллярном строении частиц распространялось на все системы, изучаемые коллоидной химией, в том числе и на лиофильные золи. Однако последующие исследования показали, что лиофильные золи, или, точнее, растворы высокомолекулярных и высокополимерных соединений, имеют другое, весьма отличное от лиофобных золей строение. В настоящее время мицеллярная теория строения коллоидных частиц, сохраняет свое значение только для лиофобных (гидрофобных) золей.
Всякий лиофобный (гидрофобный) коллоидный раствор состоит из двух частей: мицелл и интермицеллярной жидкости. Мицеллы — это отдельные коллоидные частицы, которые в совокупности составляют дисперсную фазу золя, а интермицеллярная жидкость — это дисперсионная среда того же золя, включающая помимо растворителя все другие растворенные в нем вещества (электролиты и неэлектролиты), которые не входят в состав мицелл.
Коллоидная мицелла имеет значительно более сложное строение, чем обычные молекулы. В ней различают две основные части: внутреннюю — нейтральную, обычно называемую ядром, и внешнюю — ионогенную, в свою очередь состоящую из двух слоев (двух ионных сфер).
Ядро составляет основную массу коллоидной мицеллы и представляет собой комплекс, состоящий из атомов (в случае гидрозолей металлов или неметаллов) или нейтральных молекул [в золях гидроксида железа (III) или иодида серебра]. Общее число входящих в состав ядра атомов или молекул огромно (от нескольких сот до миллионов) и зависит от степени дисперсности золя и от размеров самих атомов или молекул.
В процессе образования гидрофобного золя рост ядра в той или иной стадии может быть приостановлен созданием так называемого адсорбционного слоя из ионов стабилизатора. Ионная сфера вокруг ядра коллоидной мицеллы состоит из двух слоев (или двух сфер)— адсорбционного и диффузного. Адсорбционный слой слагается из слоя потенциалопределяющих ионов, адсорбированных на поверхности ядра и сообщающих ему свой заряд, и части противоионов, проникших за плоскость скольжения и наиболее прочно связанных электростатическими силами притяжения. Вместе с ядром эта ионная атмосфера образует как бы отдельный гигантских размеров многозарядный ион — катион или анион, называемый гранулой. Диффузный слой, расположенный за плоскостью скольжения, в отличие от адсорбционного не имеет в дисперсионной фазе резко очерченной границы. Этот слой состоит из противоионов, общее число которых равняется в среднем разности между всем числом потенциалопределяющих ионов и числом противоионов, находящихся в адсорбционном слое.
Гранула вместе с диффузным слоем противоионов составляет коллоидную частицу — мицеллу. Мицелла всегда электронейтральна. Необходимо отметить, что противоионами могут служить любые ноны тех электролитов, которые участвуют в реакциях при образовании данного золя или же присутствуют как посторонние примеси. Для примера рассмотрим получение гидрозоля иодида серебра методом конденсации. Оно основано на химической реакции

Согласно теории строения коллоидной мицеллы ядро в данном случае будет состоять из нейтральных молекул AgI. В зависимости от относительной концентрации реагирующих веществ может быть три случая.
1. Концентрация нитрата серебра больше концентрации иодида калия. При этом в системе, помимо нерастворимого комплекса Agl, имеются ионы Ag+, K+ и NO3-. В процессе роста ядра коллоидной мицеллы достраивание решетки AgI идет только за счет ионов Ag+, которые прочно входят в его структуру, сообщают ему электрический заряд и потому называются потенциалопределяющими. Полученный в результате адсорбции ионов Ag+ электрический заряд определяет термодинамический потенциал.
Положительно заряженное ядро притягивает оставшиеся в растворе противоионы NО3-. Часть противоионов при этом входит в состав адсорбционного слоя, оставшаяся часть — в

состав диффузного слоя. На рис. 6.14 изображена схема постепенного образования мицеллы гидрозоля AgI.
2. Концентрация нитрата серебра меньше концентрации иодида калия. В этом случае поверхность ядра адсорбирует только анион I–, который входит в его структуру и определяет знак заряда.
3. Концентрации нитрата серебра и иодида калия равны. В этом случае золь находится в так называемом изоэлектрическом состоянии, т. е. в состоянии, при котором электрокинетический потенциал (дзета-потенциал) равен нулю. В этом случае противоионы диффузного слоя перешли в адсорбционный слой, а потому гранула лишена заряда.
Строение мицелл в коллоидной химии принято выражать особыми мицеллярными формулами. Так, в обобщенном и упрощенном виде строение любой мицеллы гидрофобного золя можно передать следующими формулами: {m[ядро]nК+(n—х)А-}+хА- — положительно заряженная мицелла; {m[ядро]nА-(n—х)К+}-хК+— отрицательно заряженная мицелла, где К+ — катионы; А–—анионы; n — число потенциалопределяющих ионов; х — число ионов, находящихся в диффузном слое; m — число нейтральных атомов или молекул в ядре.
В этих формулах в квадратные скобки заключено ядро, а в фигурные— заряженный комплекс (гранула).
Мицеллярная формула иодида серебра для случая, когда CAgNO3>CK1, имеет вид

Для случая, когда

Когда концентрации обоих электролитов равны,
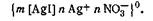
Рассмотрим примеры образования и строения мицелл различых золей. Подвергая гидролизу разбавленный раствор FeCl3, можно получить коллоидный раствор гидроксида железа (III). Реакция гидролиза протекает по уравнению

Ионным стабилизатором для этого золя является FeOCl, образующаяся по уравнению

Молекула стабилизатора диссоциирует по уравнению

Таким образом, ядро коллоидной мицеллы гидроксида железа Fe(OH)3 состоит из большого числа молекул Fe(OH)3. Потенциалопределяющим ионом является FeO+, так как ион Сl- не входит в состав ядра. Исходя из этого мицеллярная формула золя гидроксида железа (III) может быть изображена следующим образом:
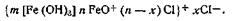
На рис. 6.15, а приведено схематическое изображение мицеллы гидроксида железа (III), а на рис. 6.16, б — мицеллы сульфида мышьяка.
Золь кремниевой кислоты относится к группе отрицательно заряженных золей. Ядро мицеллы состоит из скопления молекул кремниевой кислоты, часть которых,
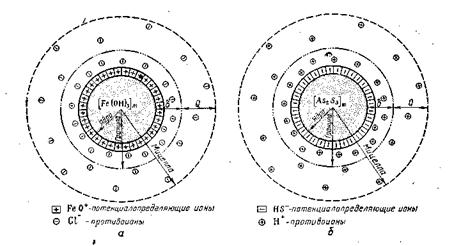
Рис.6.16 находящаяся на поверхности ядра, диссоциирует на ионы по уравнению

причем ионы SiO32-, как прочно связанные с ядром, являются потенциалопределяющими. Роль компенсирующих ионов (противоионов) выполняют ионы водорода, которые распределяются как в адсорбционном, так и в диффузном слоях. Схематически строение коллоидной мицеллы этого золя можно изобразить формулой

Рассмотренная выше мицеллярная теория строения гидрофобных коллоидов дает возможность наглядно представить схему движения гранулы и
Форма коллоидных частиц может быть самой разнообразной. Изучение строения и процесса образования коллоидных частиц с помощью электронного микроскопа позволило установить, что их форма во многом определяется типом кристаллической решетки ядра, которую образуют входящие в него атомы и молекулы. В зависимости от природы вещества решетка может быть как симметричной, так и асимметричной.
От формы частиц дисперсной фазы зависят некоторые свойства коллоидных растворов. Так, коллоидные системы асимметрического строения способны образовать внутреннюю сетчатую структуру.
Опыты показали, что в случае гидрофобных коллоидов прибавление электролита к коллоидному раствору почти не влияет на термодинамический потенциал, тогда как на электрокинетический потенциал (дзета-потенциал) оказывает сильное влияние.
Благодаря чувствительности к изменению концентрации электролитов в золе электрокинетический потенциал играет большую роль для характеристики состояния различных гидрофобных систем. Во всех электрокинетических явлениях (электроосмос, электрофорез) ему принадлежит ведущая роль. Любые изменения величины и знака электрокинетического потенциала могут привести к существенным изменениям в золях, вплоть до разрушения коллоидного раствора с выпадением дисперсной фазы в осадок (процесс коагуляции). Таким образом, дзета-потенциал является одним из важнейших факторов устойчивости гидрофобных золей. Опыт показывает, что чем больше величина этого потенциала, тем более устойчива коллоидная система.
Дата добавления: 2014-11-13; просмотров: 1051; Мы поможем в написании вашей работы!; Нарушение авторских прав |