
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Изменение энтропии.
В замкнутой системе для обратимых процессов ∆S=0 ; для необратимых
циклов ∆S >0.
Неравенство Клаузиуса: энтропия замкнутой системы
может либо возрастать (в случае необратимых процессов) либо оставаться постоянной (в случае обратимых процессов). 
Поскольку dS и 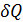 имеют один и тот же знак, то по характеру изменения энтропии можно судить о направлении процесса теплообмена. При нагревании тела
имеют один и тот же знак, то по характеру изменения энтропии можно судить о направлении процесса теплообмена. При нагревании тела  >0 и его энтропия возрастает dS >0, при охлаждениии
>0 и его энтропия возрастает dS >0, при охлаждениии 
энтропия тела убывает dS <0.
Изоэнтропийным называется процесс, протекающий при постоянной энтропии (S = const).
В обратимом адиабатическом процессе 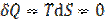 , так что
, так что  и
и
S = const, поэтому адиабатический процесс является изоэнтропийным.
Рассмотрим для примера идеальный газ, который совершает равновесный переход из состояния 1 в состояние 2. Изменение его энтропии

Используя 

Изменение энтоопии в пооиессах идеального газа

43.Статистическое толкование энтропии.
Термодинамическая вероятность W состояния тела или системы это число способов, которыми может быть реализовано данное конкретное термодинамическое состояние (макросостояние). Иначе говоря, это число всевозможных микрораспределений частиц по координатам и скоростям (микросостояний), которыми может быть осуществлено данное макросостояние.
Формула Больцмана  ,где k - постоянная Больцмана.
,где k - постоянная Больцмана.
Энтропия системы определяется логарифмом числа микросостояний, с помощью которых может быть реализовано данное макросостояние.
Энтропия является мерой неупорядоченности системы, - чем больше число микросостояний, реализующих данное макросостояние, тем больше энтропия.
44.Принцип возрастания энтропии.
Все процессы в замкнутой системе ведут к увеличению её энтропии. В замкнутой системе идут в направлении от менее вероятных состояний к более вероятным, до тех пор, пока вероятность состояния не станет максимальной. В состоянии равновесия - наиболее вероятного состояния системы - число микросостояний максимально, при этом максимальна и энтропия.
45.Второе начало термодинамики.
Любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает (закон возрастания энтропии).
Первое начало термодинамики выражает закон сохранения и превращения энергии применительно к термодинамическим процессам.
Второе начало термодинамики определяет направление протекания термодинамических процессов, указывая, какие процессы в природе возможны, а какие - нет.
Существуют ещё две формулировки второго начала термодинамики, эквивалентных закону возрастания энтропии:
1) по Кельвину: невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу;
2) по Клаузиусу: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к телу более нагретому.
46.Третье начало термодинамики.
Третье начало термодинамики - теорема Нернста-Планка
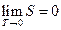
- постулирует поведение термодинамических систем при нуле Кельвина (абсолютном нуле): энтропия всех тел в состоянии равновесия стремится к нулю по мере приближения температуры к нулю Кельвина.
Теплоемкости  и
и 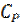 при T=0 K равны нулю, поскольку
при T=0 K равны нулю, поскольку 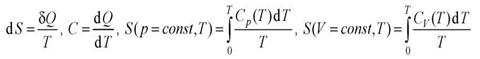
47.Тепловые двигатели и холодильные машины.
Тепловой двигатель - это периодически действующий двигатель, совершающий работу за счет полученной извне теплоты.
Термостатом называется термодинамическая система, которая может обмениваться теплотой с телами практически без изменения собственной температуры.
Рабочее тело - это тело, совершающее круговой процесс и обменивающееся энергией с другими телами.
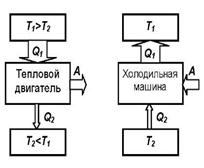 Принцип работы теплового двигателя: от термостата с более высокой температурой
Принцип работы теплового двигателя: от термостата с более высокой температурой  , называемого нагревателем, за цикл отнимается количество теплоты
, называемого нагревателем, за цикл отнимается количество теплоты  , а термостату с более низкой температурой
, а термостату с более низкой температурой  называемому холодильником, за цикл передается количество теплоты
называемому холодильником, за цикл передается количество теплоты  , при этом совершается работа A=
, при этом совершается работа A= 
Термический КПД двигателя

Чтобы КПД был равен 1, необходимо, чтобы  , а это запрещено вторым началом термодинамики.
, а это запрещено вторым началом термодинамики.
Процесс, обратный происходящему в тепловом двигателе, используется в холодильной машине: от термостата с более низкой температурой 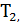 за цикл отнимается количество теплоты
за цикл отнимается количество теплоты 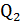 и отдается термостату с более высокой температурой
и отдается термостату с более высокой температурой  . При этом Q=
. При этом Q=  = А или
= А или  + А.
+ А.
Количество теплоты  , отданное системой термостату
, отданное системой термостату  , больше количества теплоты
, больше количества теплоты  полученного от термостата
полученного от термостата  на величину работы, совершенной над системой.
на величину работы, совершенной над системой.
Эффективность холодильной машины характеризует холодильный коэффициент  - отношение отнятой от термостата с более низкой температурой количества теплоты
- отношение отнятой от термостата с более низкой температурой количества теплоты  к работе A , которая затрачивается на приведение холодильной машины в действие
к работе A , которая затрачивается на приведение холодильной машины в действие 
48.Теорема Карно
Из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей  и холодильников
и холодильников  , наибольшим КПД обладают обратимые машины. При этом КПД обратимых машин, работающих при одинаковых температурах нагревателей и холодильников, равны друг другу и не зависят от природы рабочего тела, а определяются только температурами нагревателя и холодильника.
, наибольшим КПД обладают обратимые машины. При этом КПД обратимых машин, работающих при одинаковых температурах нагревателей и холодильников, равны друг другу и не зависят от природы рабочего тела, а определяются только температурами нагревателя и холодильника.
49.Цикл Карно.
 Наиболее экономичный обратимый круговой процесс, состоящий из двух изотерм и двух адиабат.
Наиболее экономичный обратимый круговой процесс, состоящий из двух изотерм и двух адиабат.
Рассмотрим прямой цикл Карно, в котором в качестве рабочего тела используется идеальный газ, заключенный в сосуд с подвижным поршнем.
Последовательные термодинамические процессывцикле Карно1-изотепма-2-адиабата-3-изотепма-4-адиабата-1:

Работа, совершаемая в результате кругового процесса
А=  =
= 
Для адиабат 2-3 и 4-1 равнения Пуассона 
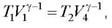 откуда
откуда 
Используя это, термический КПД цикла Карно

действительно определяется только температурами нагревателя и холодильника.
Дата добавления: 2014-10-31; просмотров: 2245; Мы поможем в написании вашей работы!; Нарушение авторских прав |