
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Реальные газы, жидкости и твердые тела.
При рассмотрении реальных газов необходимо учитывать собственный объем молекул и силы межмолекулярного взаимодействия.
Силы межмолекулярного взаимодействия - короткодействующие - они проявляются на расстояниях менее  м. Сила взаимодействия молекул - это равнодействующая сил притяжения Fп (они преобладают на больших расстояниях) и сил отталкивания F0 (они доминируют на малых расстояниях). На расстоянии r = r0 эти силы уравновешивают друг друга и F = 0. Таким образом, расстояние r0 - это равновесное расстояние между молекулами, на котором бы они находились в отсутствие теплового движения.
м. Сила взаимодействия молекул - это равнодействующая сил притяжения Fп (они преобладают на больших расстояниях) и сил отталкивания F0 (они доминируют на малых расстояниях). На расстоянии r = r0 эти силы уравновешивают друг друга и F = 0. Таким образом, расстояние r0 - это равновесное расстояние между молекулами, на котором бы они находились в отсутствие теплового движения.
Потенциальная энергия взаимодействия молекул U минимальна в состоянии устойчивого равновесия при r = r0 .
 Соотношение между Umin и кТ является критерием различных агрегатных состояний.определяет
Соотношение между Umin и кТ является критерием различных агрегатных состояний.определяет
работу, которую нужно совершить против сил притяжения, чтобы разъединить молекулы, находящиеся в равновесии (r = r0). кТ определяет удвоенную среднюю энергию, приходящуюся на одну степень свободы теплового движения молекул.
При Umin << kTвещество находится в газообразном состоянии, т.к. тепловое движение молекул препятствует соединению (конденсации) молекул.
При Umin >> kTвещество находится в твердом состоянии, т.к. тепловой энергии недостаточно, чтобы "оторвать" молекулы друг от друга.
При Umin 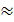 kTвеществонаходитсявжидком состоянии, т.к. в результате теплового движения молекулы перемещаются в пространстве, обмениваясь местами, но не расходясь на расстояния, превышающие r0.
kTвеществонаходитсявжидком состоянии, т.к. в результате теплового движения молекулы перемещаются в пространстве, обмениваясь местами, но не расходясь на расстояния, превышающие r0.
50.Уравнение Ван-дер-Ваальса.
Внесем в уравнение состояния идеального газа 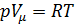 поправки,
поправки,
учитывающие собственный объем молекул и силы межмолекулярного взаимодействия.
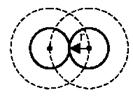 Фактический объем реального газа будет
Фактический объем реального газа будет 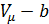 , где
, где
b - объем, занимаемый самими молекулами. Две молекулы радиуса r не могут сблизиться на расстояние меньше 2r, следовательно, для центров двух молекул недоступен сферический объем радиуса 2r. Этот объем b в восемь раз больше объема одной молекулы и в расчете на одну молекулу равен учетверенному объему молекулы.
Учет сил межмолекулярного притяжения осуществляется введением дополнительного давления p’ на газ, называемого внутренним давлением,

где a - постоянная Ван-дер-Ваальса.
Уравнение Ван-дер-Ваальса для моля газа - уравнение состояния реальных газов
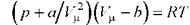
Для произвольной массы газа
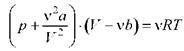 где
где 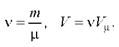
 51.Изотермы реальных газов.
51.Изотермы реальных газов.
Изотерма реального газа представляет собой зависимость молярного объема газа от
давления при постоянной температуре .
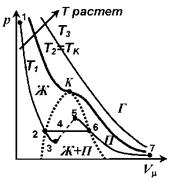
При высоких температурах (Т >Тк) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением формы.
При некоторой температуре Тк - критической температуре - на изотерме появляется точка перегиба К - критическая точка. Соответствующие этой точке объем Vk и давление ркназываются критическими. Изотерма при Тк называется критической изотермой.
При Т<Тк уравнению Ван-дер-Ваальса соответствует кривая 1-2-3-4-5-6-7. Однако, на участке 5-3 сжатие вещества сопровождается уменьшением давления, следовательно в этой области вещество распадается на две фазы - жидкость и пар.
Фаза - совокупность всех частей системы, обладающих одинаковым химическим составом и находящихся в одинаковом термодинамическом состоянии
Истинные докритические изотермы реального газа имеют вид 1-2-6-7 и являются кривыми непрерывного перехода вещества из газообразного состояния (Г) (участок 6-7) в жидкое (Ж) (участок 2-1). Участок 6-2 соответствует равновесному сосуществованию жидкости и газа.
Вещество в газообразном состоянии при температуре ниже критической называется паром (П), а пар, находящийся в равновесии со своей жидкостью, называется насыщенным (Ж+П). Пар при изотермическом сжатии претерпевает процесс сжижения. Газ при температурах Т >Тк не может быть превращен в жидкость ни при каком давлении (Г).
При некоторых условиях могут быть реализованы метастабильные состояния 5-6 и 2-3. Участок 2-3 изображает перегретую жидкость, 5-6 - пересыщенный пар.
52.Внутренняя энергия реального газа.
Внутренняя энергия реального газа складывается из кинетической энергии теплового движения молекул ( 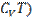 и потенциальной энергии межмолекулярного взаимодействия
и потенциальной энергии межмолекулярного взаимодействия 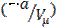 .
.
 .
.
Если газ расширяется без теплообмена с окружающей средой (адиабатически, т. е. 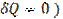 и не совершает работы (так называемое расширение газа в вакуум, т. е.
и не совершает работы (так называемое расширение газа в вакуум, т. е. 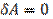 ), из первого начала термодинамики
), из первого начала термодинамики
( 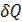 =( U2- Ul )+
=( U2- Ul )+ 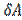 ) следует, что Ul=U2.
) следует, что Ul=U2.
При адиабатическом расширении без совершения внешней работы внутренняя энергия газа не меняется.
Для идеального газа это означает  1 = Т2 (температура не изменяется).
1 = Т2 (температура не изменяется).
Для реального газа 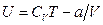 ,поэтому
,поэтому 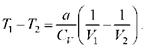
Реальный газ при адиабатическом расширении в вакуум охлаждается.
53.Жидкости и их описание.
Жидкость является агрегатным состоянием вещества, промежуточным между газообразным и твердым. В газах нет закономерности во взаимном расположении молекул (хаотическое расположение). В твердых телах наблюдается дальний порядок - молекулы образуют кристаллическую решетку. В жидкостях дальний порядок отсутствует, а имеет место ближний порядок в расположении молекул - их упорядоченное расположение повторяется на расстояниях, сравнимых с межатомными. Тепловое движение молекулы в жидкости это ее колебание около определенного положения равновесия в течение некоторого времени, после чего молекула скачком переходит в новое положение, отстоящее от исходного на расстояние порядка межатомного.
Радиус r молекулярного действия - расстояние (порядка 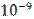 м), при котором можно пренебречь силами притяжения между молекулами жидкости.
м), при котором можно пренебречь силами притяжения между молекулами жидкости.
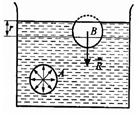 Сфера радиусом r называется сферой молекулярного действия.
Сфера радиусом r называется сферой молекулярного действия.
Силы, действующие на молекулу А внутри объема жидкости со стороны окружающих молекул, в среднем скомпенсированы. Для молекулы В, расположенной на поверхности,
равнодействующая сил R направлена внутрь жидкости.
Результирующие силы всех молекул поверхностного слоя оказывают на жидкость молекулярное (внутреннее) давление.
54.Поверхностное натяжение.
Молекулы поверхностного слоя жидкости обладают большей потенциальной энергией, чем молекулы внутри жидкости. Эта дополнительная энергия, называемая поверхностной энергией, пропорциональна площади поверхности ∆E= 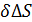 , где
, где 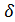 - поверхностное натяжение.
- поверхностное натяжение.
 Так как равновесное состояние характеризуется минимумом потенциальной энергии, то жидкость при отсутствии внешних сил будет принимать такую форму, чтобы при заданном объеме она имела минимальную поверхность, т.е. форму шара.
Так как равновесное состояние характеризуется минимумом потенциальной энергии, то жидкость при отсутствии внешних сил будет принимать такую форму, чтобы при заданном объеме она имела минимальную поверхность, т.е. форму шара.
Поверхностный слой жидкости аналогичен растянутой упругой пленке, в которой действуют силы натяжения.
Пусть под действием сил поверхностного натяжения поверхность жидкости стянулась (см. рисунок), при этом силы, действующие на элемент ∆l контура, совершают работу 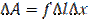 где f - сила поверхностного натяжения, действующая на единицу длины контура поверхности жидкости. Поскольку эта работа совершается за счет уменьшения поверхностной энергии
где f - сила поверхностного натяжения, действующая на единицу длины контура поверхности жидкости. Поскольку эта работа совершается за счет уменьшения поверхностной энергии 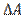 =∆E, то
=∆E, то 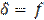 , т.е. поверхностное натяжение
, т.е. поверхностное натяжение  равно силе поверхностного натяжения приходящейся на единицу длины контура, ограничивающего поверхность.
равно силе поверхностного натяжения приходящейся на единицу длины контура, ограничивающего поверхность.
Единица поверхностного натяжения - ньютон на метр (Н/м) или джоуль на квадратный метр (Дж/м2).
55.Смачивание.
Смачиванием называется явление искривления свободной поверхности жидкости при соприкосновении жидкости с поверхностью твердого тела.
Поверхность жидкости, искривленная на границе с твердым телом, называется мениском.
Линия, по которой мениск пересекается с твердым телом, называется периметром смачивания.
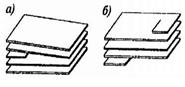
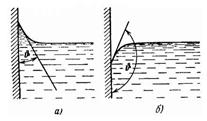 Явление смачивания характеризуется краевым углом
Явление смачивания характеризуется краевым углом 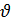 между поверхностью твердого тела и мениском в точках их пересечения (в точках периметра смачивания). Жидкость называется смачивающей твердое тело, если краевой угол острый: 0
между поверхностью твердого тела и мениском в точках их пересечения (в точках периметра смачивания). Жидкость называется смачивающей твердое тело, если краевой угол острый: 0  (рис. а) и несмачивающей, если
(рис. а) и несмачивающей, если 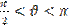 (рис.б).
(рис.б).
Если 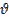 = 0, смачивание считается идеальным (полным). Случай
= 0, смачивание считается идеальным (полным). Случай 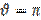 -это идеальное (полное) несмачивание.
-это идеальное (полное) несмачивание.
Если силы притяжения между молекулами твердого тела и жидкости больше, чем силы притяжения молекул жидкости друг к другу, то жидкость будет смачивающей. Если молекулярное притяжение в жидкости превышает силы притяжения молекул жидкости к молекулам твердого тела, то жидкость не смачивает твердое тело.
56.Давление под искривленной поверхностью жидкости.
Сферическая выпуклая поверхность производит на жидкость дополнительное давление, вызванное силами внутреннего натяжения, направленными внутрь жидкости, 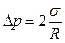 где R - радиус сферы. Если поверхность жидкости вогнутая, то результирующая сила поверхностного натяжения направлена из жидкости и давление внутри жидкости
где R - радиус сферы. Если поверхность жидкости вогнутая, то результирующая сила поверхностного натяжения направлена из жидкости и давление внутри жидкости
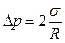
Избыточное давление внутри мыльного пузыря радиуса R вызывается действием обоих поверхностных слоев тонкой сферической мыльной пленки 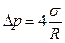
 В общем случае избыточное давление для произвольной поверхности жидкости описывается формулой Лапласа
В общем случае избыточное давление для произвольной поверхности жидкости описывается формулой Лапласа
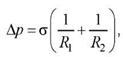
где Rl и R2 - радиусы кривизны двух любых взаимно перпендикулярных сечений поверхности жидкости в данной точке.
Радиус кривизны положителен, если центр кривизны соответствующего сечения находится внутри жидкости, и отрицателен, если центр кривизны находится вне жидкости.
57.Капиллярные явления.
Капиллярами называются узкие цилиндрические трубки с диаметром менее миллиметра.
Капиллярностью называется явление изменения уровня жидкости в капиллярах.
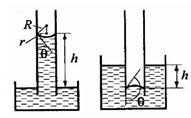 Жидкость в капилляре поднимается или опускается на такую высоту h, при которой давление столба жидкости (гидростатическое давление)
Жидкость в капилляре поднимается или опускается на такую высоту h, при которой давление столба жидкости (гидростатическое давление) 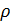 gh
gh
уравновешивается избыточным давлением ∆p
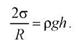
Высота поднятия (глубина опускания)
жидкости в капилляре: 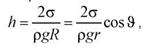
где 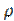 - плотность жидкости, r - радиус капилляра, R - радиус кривизны мениска,g – ускорение свободного падения.
- плотность жидкости, r - радиус капилляра, R - радиус кривизны мениска,g – ускорение свободного падения.
Высота поднятия (опускания) жидкости в капилляре обратно пропорциональна его радиусу.
58.Кристаллические и аморфные твердые тела.
Твердым телом называется агрегатное состояние вещества, характеризующееся постоянством формы и объема, причем тепловые движения частиц в них представляют собой хаотические колебания частиц относительно положений равновесия.
Твердые тела подразделяются на кристаллические и аморфные.
Кристаллические тела - это твердые тела, имеющие упорядоченное, периодически
повторяющееся расположение частиц.
Структура, для которой характерно регулярное расположение частиц с периодической повторяемостью в трех измерениях, называется кристаллической решеткой.
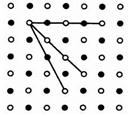 Точки, в которых расположены частицы, а точнее - средние равновесные положения, около которых частицы совершают колебания, называются узлами кристаллической решетки.
Точки, в которых расположены частицы, а точнее - средние равновесные положения, около которых частицы совершают колебания, называются узлами кристаллической решетки.
Характерной особенностью кристаллов является их анизотропность - зависимость физических свойств (упругих , механических , тепловых, электрических, магнитных, оптических ) от направления. Анизотропия кристаллов объясняется тем, что плотность расположения частиц по разным
направлениям не одинакова.
Если кристаллическое тело состоит из единственного кристалла, оно называется монокристаллом. Если твердое тело состоит из множества беспорядочно ориентированных кристаллических зерен, оно называется поликристаллом. В поликристаллах анизотропия наблюдается только для отдельных мелких кристалликов.
Твердые тела, физические свойства которых одинаковы по всем направлениям (изотропны), называются аморфными. Для аморфных тел, как и для жидкостей, характерен ближний порядок в расположении частиц, но, в отличие от жидкостей, подвижность частиц в них довольно мала.
Органические аморфные тела, молекулы которых состоят из большого числа одинаковых длинных молекулярных цепочек, соединенных химическими связями, называются полимерами (например, каучук, полиэтилен, резина).
59.Типы кристаллов.
В зависимости от рода частиц, расположенных в узлах кристаллической решетки, и характера сил взаимодействия между ними кристаллы подразделяются на четыре типа: ионные, атомные, металлические, молекулярные.
 Ионные кристаллы. В узлах кристаллической решетки располагаются
Ионные кристаллы. В узлах кристаллической решетки располагаются
поочередно ионы противоположного знака. Структуры решеток двух наиболее характерных ионных кристаллов - NaCl (решетка представляет собой две одинаковые гранецентрированные кубические решетки, вложенные друг в друга; в узлах одной из этих решеток находятся ионы Na+, в узлах другой - ионы СГ) и CsCl (кубическая объемно - центрированая решетка - в центре каждой элементарной ячейки находится ион) - показаны на рисунке. Связь, обусловленная кулоновскими силами притяжения между разноименно заряженными ионами, называется ионной.
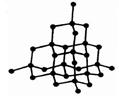 Атомные кристаллы. В узлах кристаллической решетки располагаются нейтральные атомы, удерживающиеся в узлах решетки ковалентными связями квантово-механического происхождения (у соседних атомов обобществляются валентные электроны, наименее связанные с атомом).
Атомные кристаллы. В узлах кристаллической решетки располагаются нейтральные атомы, удерживающиеся в узлах решетки ковалентными связями квантово-механического происхождения (у соседних атомов обобществляются валентные электроны, наименее связанные с атомом).
 Пример атомных кристаллов - алмаз и графит.
Пример атомных кристаллов - алмаз и графит.
В алмазе каждый атом углерода связан с четырьмя такими же атомами, которые располагаются на одинаковых расстояниях от него в вершинах тетраэдра. В графите атомы углерода упакованы в плоские слои, связанные между собой слабыми ван-дер-ваальсовыми силами.
Металлические кристаллы. В узлах кристаллической решетки располагаются положительные ионы металла. При образовании кристаллической решетки валентные электроны, слабо связанные с атомами, отделяются от атомов и коллективизируются: они уже принадлежат не одному атому, как в случае ионной связи, и не паре соседних атомов, как в случае ковалентной связи, а всему кристаллу в целом.
Молекулярные кристаллы. В узлах кристаллической решетки располагаются нейтральные молекулы вещества, силы взаимодействия между которыми обусловлены незначительным взаимным смещением электронов в электронных оболочках атомов. Эти силы называются ван-дер-ваальсовыми, тат как они имеют ту же природу, что и силы притяжения между молекулами, приводящими к отклонению газов от идеальности. Примеры молекулярных кристаллов - органические соединения (например, парафин), инертные газы (Ne, Ar, Кг, Хе) и атмосферные газы СO2, O2, N2 в твердом состоянии, лед, и т.д.
60. Дефекты в кристаллах.
Дефектами кристаллической решетки называются отклонения от упорядоченного расположения частиц в узлах решетки. Дефекты делятся на макроскопические, возникающие в процессе образования и роста кристаллов (например, трещины, поры, инородные макроскопические включения), и микроскопические, обусловленные микроскопическими отклонениями от периодичности.
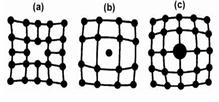 Микродефекты делятся на точечные и линейные. Точечные дефекты бывают трех типов: (1) вакансия - отсутствие атома в узле кристаллической
Микродефекты делятся на точечные и линейные. Точечные дефекты бывают трех типов: (1) вакансия - отсутствие атома в узле кристаллической
решетки (а); (2) междоузельный атом - атом, внедрившийся в междоузель- ное пространство (b); (3) примесный атом - атом примеси, либо замещающий атом основного вещества в кристаллической решетке (примесь замещения (с)), либо внедрившийся в междоузельное пространство (примесь внедрения). Точечные дефекты нарушают только ближний порядок в кристаллах.
Линейные дефекты нарушают дальний порядок. Особое место среди линейных дефектов занимают дислокации - линейные дефекты, нарушающие
 правильное чередование атомных плоскостей. Различают краевые (край атомной плоскости, обрывающейся в кристалле (рис.а) и винтовые (атомные плоскости образуют винтовую поверхность (рис. б) дислокации
правильное чередование атомных плоскостей. Различают краевые (край атомной плоскости, обрывающейся в кристалле (рис.а) и винтовые (атомные плоскости образуют винтовую поверхность (рис. б) дислокации
61 .Теплоемкость твердых тел.
Рассмотрим идеальную кристаллическую решетку, в узлах которой частицы, принимаемые за материальные точки, колеблются вблизи положений равновесия в трех взаимно перпендикулярных направлениях (три колебательные степени свободы, каждая из которых обладает энергией кТ).
Внутренняя энергия моля твердого тела 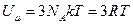 ,где Na - число Авогадро, R - молярная газовая постоянная.
,где Na - число Авогадро, R - молярная газовая постоянная.
Молярная теплоемкость твердого тела:
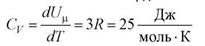
- закон Дюлонга и Пти - молярная теплоемкость химически простых тел в кристаллическом состоянии одинакова (равна 3R) и не зависит от температуры.
Если твердое тело является химическим соединением (например NaCl), то число частиц в моле равно nNA, где п - число атомов в молекуле (для NaCl число частиц в моле равно 2NA, поскольку в одном моле NaCl содержится NA атомов Na и N4 атомов Сl).
Молярная теплоемкость твердых химических соединений
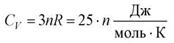
т.е. равна сумме атомных теплоемкостей элементов, составляющих это соединения.
Отклонения от закона Дюлонга и Пти (особенно при низких температурах) объясняются исходя из квантовых представлений.
62. Изменение агрегатного состояния.
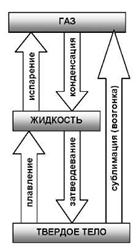 И в жидкостях и в твердых телах всегда есть некоторое число молекул, энергия которых достаточна для преодоления притяжения к другим молекулам, и которые способны покинуть поверхность жидкости или твердого тела. Такой процесс для жидкости называется испарением (или парообразованием), для твердых тел - сублимацией (или возгонкой).
И в жидкостях и в твердых телах всегда есть некоторое число молекул, энергия которых достаточна для преодоления притяжения к другим молекулам, и которые способны покинуть поверхность жидкости или твердого тела. Такой процесс для жидкости называется испарением (или парообразованием), для твердых тел - сублимацией (или возгонкой).
Конденсацией называется переход вещества вследствие его охлаждения или сжатия из газообразного состояния в жидкое.
Если число молекул, покидающих жидкость за единицу времени через единичную поверхность, равно числу молекул, переходящих из пара в жидкость, то наступает динамическое
равновесие между процессами испарения и конденсации. Пар, находящийся в равновесии со своей жидкостью, называется насыщенным.
Плавлением называется переход вещества из кристаллического (твердого) состояния в жидкое. Плавление происходит при определенной,
 возрастающей с увеличением внешнего давления, температуре плавления
возрастающей с увеличением внешнего давления, температуре плавления 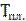 |.
|.
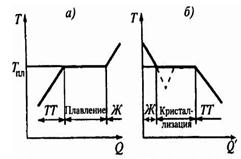
В процессе плавления теплота Q, сообщаемая веществу, идет на совершение работы по разрушению кристаллической решетки, и поэтому 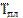 = const (рис.(а)) до расплавления всего кристалла.
= const (рис.(а)) до расплавления всего кристалла.
Количество теплоты L, необходимое для расплавления 1кг вещества, называется удельной теплотой плавления.
Если жидкость охлаждать, то процесс пойдет в обратном направлении (рис.(б)), Q’ - количество теплоты, отдаваемое телом при кристаллизации): сначала температура жидкости понижается, затем при постоянной температуре, равной  , начинается кристаллизация.
, начинается кристаллизация.
Для кристаллизации вещества необходимо наличие центров кристаллизации - кристаллических зародышей, которыми могут быть как кристаллики образующегося вещества, так и любые инородные включения. Если в чистой жидкости нет центров кристаллизации, то она может быть охлаждена до температуры, меньшей температуры кристаллизации, образуя при этом переохлажденную жидкость (рис.(б) - пунктир).
Аморфные тела являются переохлажденными жидкостями.
Дата добавления: 2014-10-31; просмотров: 602; Мы поможем в написании вашей работы!; Нарушение авторских прав |