
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Ідеальний газ. Тиск газу. Основне рівняння МКТ
При вивченні явищ в природі і техніці практично неможливо врахувати всі чинники, що впливають на хід того або іншого явища. Проте з досліду завжди можна встановити найважливіші з них. Тоді всіма іншими чинниками, що не мають вирішального впливу на хід явища, можна нехтувати. На цій основі створюється уявлення про таке явище, що ідеалізується (спрощене). Потім теоретично вивчають хід явища в ідеальних умовах, тобто при дії тільки найважливіших чинників. Створена на цій основі модель явища допомагає вивчати процеси, що реально відбуваються, і передбачати їх хід в різних випадках. Розглянемо одне з понять, що таких ідеалізуються.
Фізичні властивості газу визначаються хаотичним рухом його молекул, а взаємодія молекул газу істотного впливу на його властивості не надає, до того ж ця взаємодія має характер зіткнень, силами притягання молекул часто можна нехтувати. Сили відштовхування виникають при зіткненні молекул на дуже короткий час, й більшу частину часу молекули газу рухаються як вільні частинки.
Це дозволяє ввести поняття ідеального газу, в якому сили тяжіння між молекулами повністю відсутні і часто можна взагалі не враховувати взаємодії між молекулами, вважаючи їх абсолютно вільними. При невисокому тиску і не дуже низьких температурах це дійсно так.
Власний об'єм молекул газу складає нікчемну частину від об'єму, зайнятого газом (якщо газ не сильно стиснутий); це, до речі сказати, теж відповідає тому, що природа молекул газу не впливає істотно на його властивості. Отже, молекули ідеального газу завжди повинні мати нехтує малий об'єм в порівнянні із загальним об'ємом, зайнятим газом. В цьому значенні молекули одноатомного ідеального газу можна представити у вигляді матеріальних крапок, а молекули багатоатомного газу — у вигляді жорстко зв'язаних матеріальних крапок.
Отже, під ідеальним газом мають на увазі такий газ, в якому можна нехтувати взаємодією між молекулами, а молекули прийняти за матеріальні точки.
Оскільки молекули ідеального газу ні за яких умов не притягуються один до одного, він повинен залишатися в газоподібному стані за будь-яких зовнішніх умов.
Всі реальні гази при невеликому тиску і не дуже низьких температурах підкоряються простим загальним законам, в точності справедливим лише для ідеального газу. Вивчення властивостей ідеального газу дозволило зробити ряд теоретичних висновків, що заглиблюють наші уявлення про явища природи.
При високому тиску молекули реального газу зближуються настільки, що сили тяжіння починають грати помітну роль. Істотний вплив на поведінку молекул в цих умовах надає і власний об'єм молекул. Тому при високому тиску властивості реальних газів залежать від природи газу і істотно відрізняються від властивостей ідеального газу. Це ж відноситься і до реальних газів при низьких температурах.
За своїми властивостями ближче всього до ідеального газу підходять водень і гелій при не дуже великому тиску і не дуже низьких температурах.
Тиск газу на стінку судини обумовлений ударами молекул. Чим більше кінетична енергія поступального руху кожної молекули, тим більше сила, що виникає при її ударі об стінку.
Якщо всі молекули однакові, то загальна  .
.
Розділимо загальну кінетичну енергію на кількість молекул:
 . Величину
. Величину  називають середньою кінетичною енергією
називають середньою кінетичною енергією  поступального руху молекул.
поступального руху молекул.
Крім того, чим більше молекул в одиниці об'єму п0, тим частіше вони ударяються об стінку. Тому тиск газу прямо пропорційно середній кінетичній енергії поступального руху молекул газу і їх числу в одиниці об'єму:
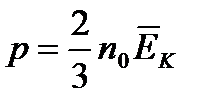
Цю формулу можна вивести на основі молекулярно-кінетичної теорії. Формула має дуже велике значення і називається основним рівнянням молекулярно-кінетичної теорії газів.
Візьмемо посудину у формі куба з ребром l. Припустимо, що усередині куба в кожній одиниці об'єму міститься n0 однакових молекул газу. Оскільки молекули рухаються, то кожна з них володіє імпульсом mv (тут m — маса однієї молекули, v - швидкість її руху). Будемо вважати удари молекул об стінку абсолютно пружними. Тоді, якщо молекула рухається перпендикулярно до стінки посудини при ударі вона спочатку зупиняється, тобто втрачає імпульс mv, а потім відскакує від стінки і рухається в протилежний бік із швидкістю – v, тобто набуває протилежно направленого імпульсу— mv.
| l |
| v |
| m |
Хай ця молекула безперешкодно рухається між лівою і правою стінками куба. При кожному ударі вона повідомляє стінці імпульс 2mv. У відповідності із законами механіки середня сила дії молекули на стінку F1=2mv/Δt, де Δt - час руху молекули від однієї стінки до іншої і назад, тобто Δt =2l/v, оскільки молекула завдає стінці удару з таким проміжком часу. Отже

Сила тиск газу на стінку судини рівна сумі сил ударів окремих молекул об цю cтінку:

де N — загальне число молекул, що рухаються між двома протилежними стінками куба, а vс.к. ·— середня квадратична швидкість молекул.
Оскільки число молекул в одиниці об'єму рівно n0, сумарне число молекул в кубі рівно  . Через повну хаотичність руху молекул для кожної з них всі напрями руху рівноймовірні. Тому можна вважати, що уздовж кожного з трьох взаємно перпендикулярних напрямів рухається в середньому 1/3 загального числа молекул. Отже, при підрахунку тиску можна прийняти, що між двома протилежними стінками куба по перпендикуляру до них рухається 1/3 загального числа молекул, тобто N=(1/3)n0l 3. Таким чином,
. Через повну хаотичність руху молекул для кожної з них всі напрями руху рівноймовірні. Тому можна вважати, що уздовж кожного з трьох взаємно перпендикулярних напрямів рухається в середньому 1/3 загального числа молекул. Отже, при підрахунку тиску можна прийняти, що між двома протилежними стінками куба по перпендикуляру до них рухається 1/3 загального числа молекул, тобто N=(1/3)n0l 3. Таким чином,
 .
.
Оскільки ,  отримуємо
отримуємо 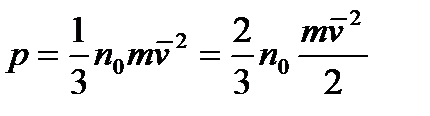
Так як  , то кінцева формула:
, то кінцева формула: 

 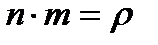  Тиск ідеального газу пропорційний добуткові густини газу і середнього квадрату швидкості поступального руху молекул.
Тиск ідеального газу пропорційний добуткові густини газу і середнього квадрату швидкості поступального руху молекул.
|
Дата добавления: 2014-12-03; просмотров: 670; Мы поможем в написании вашей работы!; Нарушение авторских прав |