
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Маса і розміри молекул. Основні поняття МКТ.
Виміряти розміри молекул шляхом прямого вимірювання так само неможливо, як і неможливо визначити її масу за допомогою терезів.
Приблизна оцінка розмірів – дослід нім. фізика Рентгена та англ. Релея. Якщо пустити краплю олії відомого об’єму на поверхню чистої води то вона розпливається, утворюючи тонку плівку, яка складається з одного шару молекул. Тому граничну товщину цієї плівки можна прийняти за діаметр молекули. Виміривши площу утвореної плівки, визначимо її товщину, тобто діаметр молекули. Наприклад, результат одного з дослідів такий: об’єм краплі олії 3,6·10-5 см3, площа поверхні плівки 90 см2, отже, товщина плівки:

Молекули і атоми настільки малі, що уявити їх розміри можна тільки шляхом порівняння. Так атом Ферруму у стільки разів менший за волоський горіх, у скільки горіх менший за Місяць.
Однак маси молекул й атомів виміряні досить точно. Вони виражаються дуже малими числами. Наприклад маса молекули кисню дорівнює 53,5·10-27 кг, водню 3,34·10-27 кг.
Ці числа незручні для практичного використання, тому з аодиницю вимірювання маси атомів і молекул прийнята атомна одиниця маси (а.о.м.).
З 1961 р. за атомну одиницю маси обрано  маси атому Карбону, оскільки Карбон входить до складу дуже великої кількості хімічних сполук.
маси атому Карбону, оскільки Карбон входить до складу дуже великої кількості хімічних сполук.
Відносна атомна маса Ar – це маса атому, виражена в атомних одиницях маси. Це відношення маси атому даної речовини до  маси атому Карбону :
маси атому Карбону :
 .
.
Воно показує у скільки разів масса атому данного елементу більша за  маси атому Карбону.
маси атому Карбону.
Якщо речовина складається не з атомів, а з молекул, то її відносна молекулярна маса 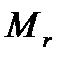 дорівнює сумі відносних атомних мас атомів, які утворюють молекулу. Приклад…
дорівнює сумі відносних атомних мас атомів, які утворюють молекулу. Приклад…
Експериментально встановлено, що 1 а.о.м.=1,660·10-27 кг
Кількість речовини – число молекул речовини в будь-якому тілі
Моль – одиниця кількості речовини. Моль дорівнює кількості речовини системи, яка містить стільки ж частинок, скільки міститься атомів в 0,012 кг карбону 12С (6.022·1023частинок).
Стала Авогадро – число молекул в 1 моль – відношення числа молекул речовини до кількості цієї речовини.
NA = 6.022·1023моль-1.  =>
=> 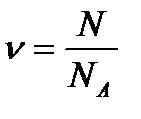
Молярна маса - маса 1 моль речовини, чисельно рівна відношенню маси речовини до кількості речовини.
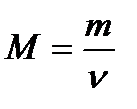 Одиниця:
Одиниця: 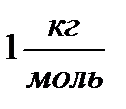
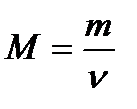
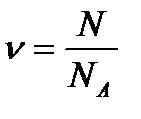 =>
=> 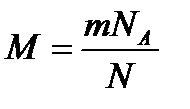
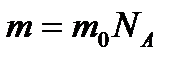 =>
=> 

Дата добавления: 2014-12-03; просмотров: 613; Мы поможем в написании вашей работы!; Нарушение авторских прав |