
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Тема: Тепловий рух. Внутрішня енергія тіла і способи її зміни. Кількість теплоти. Питома теплоємність речовини. Робота в термодинаміці. Закони термодинаміки
Термодинаміка - розділ молекулярної фізики, який вивчає теплові процеси без вияснення внутрішніх чинників структури речовини.
Термодинаміка була створена в середині ХІХ століття. Після відкриття закону збереження енергії. В її основі лежить поняття внутрішньої енергії U. У середині ХІХ століття. було доведено, що поряд з механічною енергією макроскопічні тіла мають ще й енергію всередині цих тіл. Ця внутрішня енергія входить до балансу енергетичних перетворень у природі. Після відкриття внутрішньої енергії був сформульований закон збереження і перетворення енергії в теплових процесах, у результаті якого внутрішня енергія може переходити в механічну і навпаки. З погляду МКТ речовини внутрішня енергія макроскопічного тіла термодинамічної системи дорівнює сумі кінетичних енергій неперервного теплового руху всіх молекул (атомів) відносно центра мас тіла і потенціальних енергій взаємодії всіх молекул одна з одною. Обчислити U, враховуючи мікропараметри майже неможливо, тому для її вираження використовують макропараметри термодинамічної системи.
Найбільш простий за властивостями - одноатомний газ. До одноатомних можна віднести інертні гази: гелій, неон, аргон та ін. Обчислимо внутрішню енергію одноатомного ідеального газу. Оскільки молекули цього газу одна з одною не взаємодіють, то потенціальна енергія Еп = 0. Уся внутрішня енергія складається із кінетичної енергії руху Ек. За формулою Больцмана для одного атома 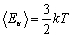 . А оскільки кількість атомів дорівнює
. А оскільки кількість атомів дорівнює 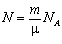 , то внутрішня енергія одноатомного ідеального газу
, то внутрішня енергія одноатомного ідеального газу 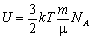 , де kNA = R. Остаточно маємо
, де kNA = R. Остаточно маємо

де m - маса всього газу; m - молярна маса; R - універсальна газова стала; T - термодинамічна температура; p - тиск газу; V - об'єм газу.
Внутрішня енергія ідеального одноатомного газу пропорційна температурі і не залежить від об'єму та інших макропараметрів. Зміна внутрішньої енергії маси ідеального газу відбувається тільки у разі зміни його температури T:
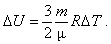
Якщо газ не одноатомний, то його молекули рухаються не тільки поступально, а й обертаються. Внутрішня енергія таких газів дорівнює сумі енергій поступального і обертального рухів.
У реальних газах, рідинах і твердих тілах середня потенціальна енергія взаємодії молекул не дорівнює нулю, тому їх внутрішня енергія залежить від об'єму речовини поряд з температурою.
Внутрішню енергію термодинамічної системи можна змінити двома способами:
1) виконанням роботи;
2) теплопередачею.
Теплопередачею або теплообміном називають процес передачі енергії від одного тіла до іншого без виконання роботи. Теплопередача може відбуватися такими способами:
1) теплопровідність;
2) випромінювання;
3) конвекція (перемішування).
Кількісну міру зміни внутрішньої енергії тіла під час теплообміну називають кількістю теплоти Q. У процесі теплообміну на межі між тілами відбувається взаємодія "повільних" молекул холодного тіла і "швидких" гарячого. У результаті кінетичні енергії молекул вирівнюються і швидкість молекул холодного тіла підвищується, а гарячого - знижується. Кількістю теплоти також називають енергію, яку гаряче тіло передає холодному в результаті теплообміну.
Кількісні вимірювання під час теплообміну виконують за допомогою калориметра, показаного на рис.3.2.2, на якому 1 - зовнішня посудина (корпус калориметра); 2 - внутрішня металева посудина (найкраще мідна, оскільки мідь - один з найкращих провідників теплоти; цю посудину ще називають власне калориметр); 3 - шар повітря; 4 - теплоізолювальна кришка; 5 - термометр; 6 - теплоізолювальні опори. Усередині калориметра зазвичай вміщують мішалку для перемішування рідини.
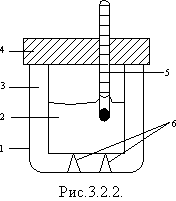
Наявність шару повітря між посудинами, теплоізолювальною кришкою і опорами утруднює всі види теплопередачі між тілами у внутрішній посудині і зовнішнім середовищем.
Якщо теплота передана тілу в результаті нагрівання чи охолодження, то експериментально встановлено, що
Q = cm(T2 - T1),
де c - коефіцієнт пропорційності, скалярна фізична величина, що називається питомою теплоємністю і яка чисельно дорівнює кількості теплоти, що відбирається або надається 1 кг речовини у разі зміни її температури на 1К:
c = Q, якщо m = 1 кг, T2 - T1 = DT = 1 К.
Внутрішня енергія тіла підвищується, коли воно отримує певну кількість теплоти від інших тіл, які його оточують (T2 > T1). У цьому разі Q > 0 і DU. Якщо ж тіло віддає певну кількість теплоти тілам (холоднішим від нього), які його оточують (T2 < T1), його внутрішня енергія зменшується: Q = DU < 0.
Одиниця кількості теплоти в СІ - джоуль: [Q] = Дж. Позасистемна одиниця кількості теплоти - калорія (кал). Калорію визначають як кількість теплоти, яку необхідно передати одному граму води, щоб збільшити його температуру на один градус Цельсія. 1 кал = 4,18 Дж.
Питому теплоту в СІ вимірюють в джоулях на кілограм на кельвін: 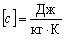 .
.
Для води 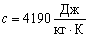 . Це досить велике значення питомої теплоємності, тому змінити температуру певної маси води досить важко. З цієї причини воду використовують як теплоносій у системах опалення. Велика теплоємність води зумовлює зменшення різких перепадів температури біля поверхні Землі, яка на 2/3 покрита водою.
. Це досить велике значення питомої теплоємності, тому змінити температуру певної маси води досить важко. З цієї причини воду використовують як теплоносій у системах опалення. Велика теплоємність води зумовлює зменшення різких перепадів температури біля поверхні Землі, яка на 2/3 покрита водою.
Питома теплоємність визначена для всіх тіл і залежить не тільки від властивостей речовини, але й від того, за яких умов здійснюється теплопередача. Наприклад, для нагрівання газу на 1 К при p = const треба передати більшу кількість теплоти Q, ніж для нагрівання при V = const.
Розглянемо інший спосіб зміни внутрішньої енергії термодинамічної системи -виконанням роботи. Виконання роботи в термодинаміці пов'язане зі зміною об'єму термодинамічної системи. Розрахуємо роботу А, яку виконує ідеальний газ внаслідок його ізобарного нагрівання. Будемо вважати, що газ знаходиться під невагомим поршнем площею S, який рухається уздовж циліндра без тертя (рис.3.2.3). Оскільки поршень не закріплений, то тиск газу p є сталим і наближено дорівнює атмосферному. Під час нагрівання на DT відбувається ізобарне розширення газу і його об'єм збільшується на DV = SDh, де S - площа поршня; Dh - висота підняття поршня. Оскільки з механіки відомо, що 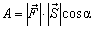 , де
, де  - сила, що діє на тіло, яке здійснює переміщення
- сила, що діє на тіло, яке здійснює переміщення  , то з урахуванням рівностей F = pS, a = 0°, |
, то з урахуванням рівностей F = pS, a = 0°, |  | = Dh знаходимо:
| = Dh знаходимо:
A = pSDh = pDV, (3.2.1)
де DV - зміна об'єму газу: DV = V2 - V1.

Формула (3.2.1) справедлива не тільки для ізобарного процесу, але і для будь-якого процесу, під час якого об'єм газу змінюється на досить малу величину DV.
Якщо в циліндрі під поршнем (рис.3.2.3) знаходиться 1 моль ідеального газу, то робота під час його ізобарного нагрівання
A = pDVm. (3.2.2)
Із рівняння Клапейрона-Менделеєва pVm = RT маємо  ,отже:
,отже:

Підставивши у (3.2.2) вираз (3.2.3) отримаємо:
Am = RDT. (3.2.4)
Із рівняння (3.2.4) при DT = 1 К R = Am. Таким чином можна сформулювати фізичний зміст універсальної газової сталої: універсальна газова стала R чисельно дорівнює роботі ізобарного розширення одного моля ідеального газу під час нагрівання його на 1 К.
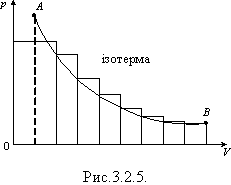
Якщо процес ізобарного розширення газу зобразити в координатах p, V, то можна помітити, що для обчислення роботи газу достатньо визначити площу фігури під графіком в цих координатах (рис. 3.2.4). Робота дорівнює площі фігури під графіком і для інших процесів, якщо вони зображені в координатах p, V, оскільки можна замінити, наприклад, реальний ізотермічний процес уявним ізобарним процесом, усереднюючи тиск (рис.3.2.5).

Під час ізохорного процесу A = 0. Розширюючись, газ виконує додатню роботу A > 0, оскільки напрям сили і напрям переміщення поршня збігаються.
У процесі розширення газ передає енергію оточуючим тілам. Якщо газ стискається, то формула для роботи газу така ж сама, але V2 < V1, тому A < 0.
Робота А, яка виконується зовнішніми тілами над газом, відрізняється від роботи газу тільки знаком, тобто A = - A' (A - робота над газом, A' - робота, яку виконує газ). Це викликано різними напрямами сили F і переміщенням поршня. Отже, робота зовнішніх сил, що діють на газ A' = - pDV. Під час стиснення газу, коли DV < 0, A' > 0, зовнішні тіла, здійснюючи над газом додатну роботу, передають йому частину своєї енергії.
Закон збереження енергії в теплових процесах (перший закон термодинаміки). Застосування першого закону термодинаміки до ізопроцесів. Адіабатний процес. Необоротність теплових процесів
Спираючись на прецезійні досліди, проведені в середині ХІХ ст., англійський фізик Джоуль та німецький Майєр, і найповніше Гельмгольц, установили закономірність, згідно з якою кількість енергії в природі незмінна, вона лише переходить від одних тіл до інших або перетворюється з одного виду в інший. Це твердження називають законом збереження і перетворення енергії. Цей закон універсальний та застосовний до всіх явищ природи.
Закон збереження енергії, поширений на теплові явища, називають першим законом термодинаміки.
У термодинаміці розглядаються тіла, положення центра тяжіння яких майже не змінюється. Механічна енергія таких тіл залишається незмінною. Змінюватися може лише внутрішня енергія U. Зміна U тіла може відбуватися за рахунок виконання роботи А або теплопередачі. У загальному випадку у разі переходу системи з одного стану в інший U змінюється одночасно як за рахунок виконання роботи, так і за рахунок теплопередачі. Саме для таких загальних випадків і застосовують перший закон термодинаміки: зміна U системи під час її переходу з одного стану в інший дорівнює сумі роботи зовнішніх сил A' і кількості теплоти, що передається системі Q:
DU = A' + Q.
Якщо система ізольована, робота над нею не виконується (A = 0) і вона не обмінюється теплотою з навколишніми тілами (Q = 0), отже, DU = 0.
Якщо врахувати, що A' = - A, то вираз першого закон термодинаміки набуде вигляду
Q = DU + A. (3.2.5)
Отже, кількість теплоти Q, що передається системі, витрачається на зміну її внутрішньої енергії U і на виконання системою роботи над зовнішніми тілами.
Внутрішня енергія змінюється внаслідок виконання роботи і шляхом теплообміну. В кожному стані система має певну внутрішню енергію U. Робота і кількість теплоти не містяться в тілі, а характеризують зміни його U.
За допомогою першого закону термодинаміки можна робити важливі висновки про характер процесів, що відбуваються. Розрізняють різні процеси, під час перебігу яких одна з фізичних величин залишається незмінною (ізопроцеси).
Якщо термодинамічною системою є ідеальний газ і його об'єм не змінюється, (ізохорний процес), то A' = 0, а зміна внутрішньої енергії, згідно (3.2.5) дорівнюватиме кількості теплоти:
DU = Q.
Ізотермічний процес. Якщо T = const внутрішня енергія системи не змінюється. Уся передана газу кількість теплоти витрачається на виконання роботи над зовнішніми тілами:
Q = A
Ізобарний процес. Кількість теплоти Q, передана газу за сталого тиску, витрачається на зміну його внутрішньої енергії і на виконання ним роботи над зовнішніми тілами:
Q = DU + A
Адіабатний процес - процес, що відбувається в теплоізольованій системі (немає обміну енергією із зовнішніми тілами). При цьому Q = 0 і змінити внутрішню енергію системи можна лише за рахунок виконання над нею роботи:
DU = A
Звичайно, неможливо оточити систему оболонкою, що абсолютно не пропускає тепло, але іноді можна вважати реальні процеси дуже близькими до адіабатних. Для цього вони мають здійснюватися так швидко, щоб за час процесу не відбулося теплообміну (наприклад, поширення звуку в повітрі), або якщо процеси відбуваються з величезними масами газу (наприклад, в атмосфері Землі).
З першого закону термодинаміки випливає неможливість побудови "вічного" двигуна першого роду, бо будь-яка система не може нескінченно довго виконувати роботу без передачі їй теплоти. Дійсно, коли Q = 0, то робота має виконуватись за рахунок внутрішньої енергії системи, яка є обмеженою.
Закон збереження і перетворення енергії стверджує, що кількість енергії за будь-яких її перетворень незмінна, але нічого в ньому не вказує на те, які енергетичні перетворення можливі. Однак багато процесів, цілком допустимих з точки зору закону збереження енергії, ніколи не відбуваються в дійсності. Наприклад, нагріте тіло, поступово охолоджуючись, передає свою енергію більш холодним тілам, які його оточують. Зворотний процес передачі теплоти від холодного тіла до гарячого самовільно відбуватися не може. Кількість таких прикладів можна навести безліч. Усі вони свідчать, що процеси в природі мають певну спрямованість. У зворотному напрямі вони самовільно відбуватися не можуть.
Усі процеси в природі необоротні. Напрям можливих енергетичних перетворень вказує другий закон термодинаміки. Він підтверджує необоротність процесів в природі і був сформульований на основі дослідних фактів Клаузіусом: неможливо перевести теплоту від більш холодної системи до більш гарячої, якщо не відбувається інших одночасних змін в обох системах або тілах, які їх оточують.
Важливість другого закону термодинаміки полягає у висновку: необоротна не тільки теплопередача, а й інші процеси в природі.
Дата добавления: 2014-12-03; просмотров: 1496; Мы поможем в написании вашей работы!; Нарушение авторских прав |