
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
АДСОРБЦИЯ 6.1 Физическая и химическая адсорбция
Адсорбция - как явление сопровождает двухфазные многокомпонентные системы.
Адсорбция - (ad - на, sorbeo - поглощаю, лат.).
Абсорбция - (ab - в, " " " ).
Адсорбция имеет место на границах раздела: газ - тв. тело, жидкость - тв. тело, газ - жидкость, в отсутствии химического взаимодействия и растворения.
Абсорбция наблюдается на границе раздела газ - жидкость и сопровождается растворением газа в объёме жидкости с последующим химическим взаимодействием или без него.
Теплота адсорбции 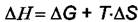 всегда отрицательна, так как
всегда отрицательна, так как 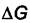 и
и
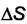 отрицательны при самопроизвольной адсорбции. Все адсорбционные процессы экзотермичны.
отрицательны при самопроизвольной адсорбции. Все адсорбционные процессы экзотермичны.
Адсорбция характеризуется величиной

т. е. числом частиц, адсорбированных на единицу поверхности s. Твёрдые адсорбенты обладают развитой поверхностью, величина которой может достигать 2000 м2/г. Если поверхность адсорбента неизвестна, то количество поглощённого газа относят к 1 см3 или к 1г адсорбента. Зависимость  или
или  при постоянной температуре называется
при постоянной температуре называется
изотермой адсорбции.
Различают два вида адсорбции - физическая и химическая адсорбция. Физическая адсорбция вызвана Ван - дер - ваальсовыми силами взаимодействия между молекулами адсорбата и адсорбента. Эти силы невелики и поэтому теплота физической адсорбции составляет ~ 10 - 30 кДж/моль. Химическая адсорбция, или хемосорбция, обязана химической связи, возникающей между адсорбатом и адсорбентом. При этом образуются поверхностные соединения. Теплота хемосорбции составляет ~ 100 — 400 кДж/моль, а сам процесс хемосорбции носит активационный характер. Молекулы адсорбата и адсорбента должны обладать энергией, которая превышает некоторое пороговое значение (энергия активации). Энергетические характеристики этих двух видов адсорбции и обуславливают их основные отличия (см таблицу 6.1.).
Физическая адсорбция неспецифична и ряд по адсорбируемости сохраняется на любом адсорбенте. Он связан с силами взаимодействия. Чем выше взаимодействие молекул адсорбата друг с другом, тем выше их нормальная точка кипения 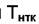 и тем больше величина
и тем больше величина  (см. таблицу 6.2).
(см. таблицу 6.2).
Таблица 6.1. Основные различия между физической и химической адсорбцией.
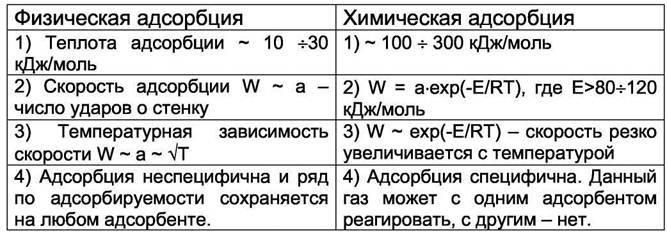
Таблица 6.2. Объёмы газов, адсорбируемых на 1г активированного угля при 15оС.
( 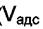 приведены к давлению р = 1 атм.)
приведены к давлению р = 1 атм.)
Дата добавления: 2014-12-23; просмотров: 739; Мы поможем в написании вашей работы!; Нарушение авторских прав |