
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Поли молекулярная адсорбция
Установлено, что адсорбция паров вблизи линии насыщения не подчиняется закону Лэнгмюра. При  с ростом давления (
с ростом давления ( 
где  - давление насыщения) энергия межмолекулярного
- давление насыщения) энергия межмолекулярного
взаимодействия становится соизмеримой с теплотой адсорбции и процесс адсорбции газа может перейти в его конденсацию. В этом
случае величина адсорбции  (рис. 6.3). Изотермы адсорбции
(рис. 6.3). Изотермы адсорбции
имеют разный вид в зависимости от энергии межмолекулярного
взаимодействия 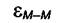 и энергии взаимодействия молекул пара с
и энергии взаимодействия молекул пара с
поверхностью адсорбента  εМ--S:
εМ--S:

Рис. 6.3. Изотермы полимолекулярной адсорбции.
1 − Полимолекулярная адсорбция при  εМ—М<εМ—S;
εМ—М<εМ—S;
2 − Полимолекулярная адсорбция при 
В 1938 г. Бруннауэр, Эмметт, Теллер опубликовали свою теорию, объясняющую такое поведение изотерм адсорбции. Основные допущения теории БЭТ сводятся к следующему:
1) После установления равновесия при давлении p и температуре Т
доля поверхности адсорбента θ0 свободна, доля θ1 занята
мономолекулярным слоем, доля θ2 покрыта бимолекулярным слоем и
т.д.
2) Равновесие между мономолекулярным слоем и паром, а также
верхними слоями полимолекулярных слоёв и паром, определяется
уравнением Лэнгмюра.
3) Образование первого слоя сопровождается выделением теплоты
адсорбции, а всех последующих - теплоты конденсации.
С учётом этих предположений уравнение полимолекулярной адсорбции БЭТ запишется в таком виде:

|
(6.7)
Величина  берётся для монослойной адсорбции. При
берётся для монослойной адсорбции. При 
величина  . При малых давлениях, когда
. При малых давлениях, когда  (6.7) переходит
(6.7) переходит
в изотерму Ленгмюра (6.3).
Дата добавления: 2014-12-23; просмотров: 308; Мы поможем в написании вашей работы!; Нарушение авторских прав |